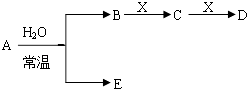
题目内容
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
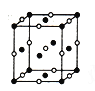
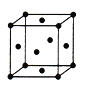
① 甲硅烷(SiH4)固态时属于___________晶体。
② 已知室温下1 g甲硅烷自燃生成SiO2和液态水放出热量44.6 kJ,则其热化学方程式为______________________。
(2)甲醇燃料电池的总反应为:2CH3OH+3O2═2CO2↑+4H2O,其工作原理如下图所示。
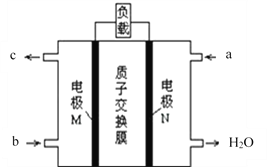
①图中CH3OH从_____________(填a或b)通入,该电池的正极是____________(填M或N)电极,其中在N极发生的电极反应式是_____________________。
②如果在外电路中有1mol电子转移,则消耗标准状况下O2的体积为_______L。
(3)25℃,101kPa条件下,14g N2和3g H2反应生成NH3的能量变化如下图所示:
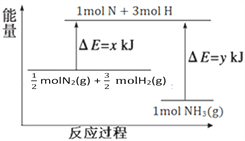
已知:① x = 1127;
② 25℃ 101kPa下,N2(g)+3H2(g)![]() 2NH3(g)△H=-92kJ·mol—1。
2NH3(g)△H=-92kJ·mol—1。
则 y =__________。
【答案】 分子 SiH4(g)+2O2(g)= SiO2(s)+2H2O(l) ΔH=-1427.2 kJ/mol b N 4H+ + O2 + 4e- = 2H2O 5.6L 1173
【解析】(1)①甲硅烷(SiH4)是由SiH4分子构成的共价化合物,在固态时属于分子晶体;②在室温下1 g甲硅烷即1/32mol,自燃生成SiO2和液态水放出44.6 kJ的热量,则其热化学方程式为SiH4(g)+2O2(g)= SiO2(s)+2H2O(l) ΔH=-1427.2 kJ/mol;
(2)根据反应方程式2CH3OH+3O2═2CO2↑+4H2O,结合原电池示意图可知CH3OH在负极反应,失去电子生成CO2,O2在正极反应,得到电子生成水,所以①CH3OH从b口通入,从c口排出CO2,O2从a口通入,电池的正极是N,负极是M,正极N上发生的电极反应为O2 +4H+ + 4e- = 2H2O;②若外电路有1mol电子转移,则消耗标况下O2的体积为![]() mol×22.4L/mol=5.6L;
mol×22.4L/mol=5.6L;
(3)根据图示的能量变化,可得![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)△H= (x-y)kJ·mol-1,结合已知条件可得2(x-y)= - 92,x = 1127,解得y=1173。
NH3(g)△H= (x-y)kJ·mol-1,结合已知条件可得2(x-y)= - 92,x = 1127,解得y=1173。

【题目】在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.该反应可表示为X+3Y2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)=0.01 molL﹣1min﹣1
D.增大压强使平衡向生成Z的方向移动