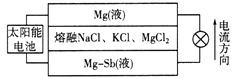
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在O2参与的反应中,1molO2作氧化剂时得到的电子数一定是4NA
B. 25℃、1.01×105Pa条件下,11.2L丙炔分子中所含碳氢键数为2NA
C. 常温下,2.7g铝分别与足量的盐酸或烧碱溶液反应时,失去的电子数都为0.3NA
D. 1molNO2与足量H20反应,转移的电子数为NA
【答案】C
【解析】A. 在O2 参与的反应中,1molO2 作氧化剂时得到的电子数不一定是4NA,如钠在氧气中燃烧生成过氧化钠时,1molO2 得到的电子数只有2NA,A不正确;B. 25℃、1.01×105Pa条件下,气体摩尔体积大于22.4L/mol,所以11.2L丙炔的物质的量小于0.5mol,分子中所含碳氢键数小于2NA,B不正确;C. 2.7g铝的物质的量为0.1mol,与足量的盐酸或烧碱溶液反应时,铝都转化为+3价铝的化合物,所以失去的电子数都为0.3NA,C正确;D. 3NO2+H2O=2HNO3+ NO,该反应中电子转移数为2e-,所以1molNO2与足量H2O反应,转移的电子数为![]() NA,D不正确。本题选C。
NA,D不正确。本题选C。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目