题目内容
6.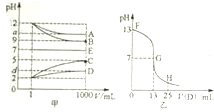 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
(2)写出A与C反应的离子方程式:NH3+H+=NH4+.
(3)图乙为室温时向25mL某浓度的B溶液中逐滴滴加0.2mol.L-1的D溶液的过程中pH的变化曲线.
①图乙中B的物质的量浓度为0.1mol.L-1
②G点溶液呈中性,则二者恰好完全反应的点是在FG(填FG、GH)区间.
③G点溶液中各离子浓度大小关系是c(Na+)=c(CH3COO-)>c(H+)=c(OH-).
(4)t℃时,A的稀溶液中c(H+)=10-amol.L-1,c(OH-)=10-bmol.L-1,已知a+b=13,该温度下(t℃),将100mL0.2mol.L-1的C溶液与100mL0.4mol.L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH=12.
分析 (1)根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸;
(2)氨水与盐酸反应生成氯化铵;
(3)①由图可知,NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L;
②醋酸与氢氧化钠恰好反应生成CH3COONa,溶液呈碱性;
③G点溶液呈中性,则c(H+)=c(OH-),再根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)判断;
(4)由A的稀溶液中c(H+)=10-amol.L-1,c(OH-)=10-bmol.L-1,且a+b=13,可知t℃时Kw=10-13,根据中和反应量的关系可知NaOH有剩余,计算剩余c(OH-),再根据水的离子积计算c(H+),再根据pH=-lgc(H+)计算.
解答 解:(1)根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸,
故答案为:NaOH;HCl;
(2)氨水与盐酸反应生成氯化铵,反应离子方程式为:NH3+H+=NH4+,故答案为:NH3+H+=NH4+;
(3)①由图可知,NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L,则c(NaOH)=c(OH-)=0.1mol/L,故答案为:0.1;
②醋酸与氢氧化钠恰好反应生成CH3COONa,溶液呈碱性,则恰好完全反应的点是在FG区间,故答案为:FG;
③G点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
故答案为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(4)由A的稀溶液中c(H+)=10-amol.L-1,c(OH-)=10-bmol.L-1,且a+b=13,可知t℃时Kw=10-13,根据中和反应量的关系可知NaOH有剩余,混合后溶液中c(OH-)=$\frac{0.1L×0.4mol/L-0.1L×0.2mol/L}{0.1L+0.1L}$=0.1mol/L,则c(H+)=$\frac{1{0}^{-13}}{0.1}$mol/L=10-12mol/L,故pH=-lgc(H+)=-lg10-12=12,
故答案为:12.
点评 本题考查了物质的推断、弱电解质的电离、离子浓度比较、酸碱混合溶液定性判断、pH计算等,关键是明确弱电解质的电离特点推断物质,题目难度中等.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g | |
| C. | 常温常压下,1.6 g CH4含原子数为0.5NA | |
| D. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA |
| A. | 油脂 | B. | 纤维素 | C. | 麦芽糖 | D. | 三硝基甲苯 |
| A. | Fe3+ | B. | CO32- | C. | Mg2+ | D. | OH- |
| A. | 溶解、过滤、蒸发、加热 | B. | 溶解、过滤、洗涤、加热 | ||
| C. | 溶解、蒸发、洗涤、过滤 | D. | 溶解、洗涤、过滤、加热 |
| A. | Z2+2M2+═2M3++2Z-不可以进行 | |
| B. | Z元素在①③反应中发生还原反应 | |
| C. | 各粒子还原性由强到弱的顺序是X2+>Z->R->M2+ | |
| D. | 各粒子氧化性由强到弱的顺序是XO4->Z2>R2>M3+ |