题目内容
15.从氯酸钾分解制氧气后的剩余物中回收二氧化锰操作顺序是( )| A. | 溶解、过滤、蒸发、加热 | B. | 溶解、过滤、洗涤、加热 | ||
| C. | 溶解、蒸发、洗涤、过滤 | D. | 溶解、洗涤、过滤、加热 |
分析 氯酸钾分解后生成KCl,二氧化锰作催化剂,且KCl溶于水,而二氧化锰不溶于水,则溶解后过滤可分离,以此来解答.
解答 解:从氯酸钾分解制氧气后的剩余物中回收二氧化锰,剩余物中含KCl、二氧化锰,KCl溶于水,而二氧化锰不溶于水,则溶解后过滤可分离出二氧化锰,然后洗涤、加热(干燥)即可,故选B.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
5.气体X可能含有Cl2、HBr、CO2中的一种或几种,已知X通入AgNO3溶液时产生淡黄色沉淀,且沉淀不溶于稀硝酸;若将X通入澄清石灰水中,却不见沉淀产生.对于气体X的成分,下列说法正确的是( )
| A. | 一定不含CO2 | B. | 一定含有HBr,可能含有CO2 | ||
| C. | 一定不含Cl2和CO2 | D. | 可能含有CO2和Cl2 |
6.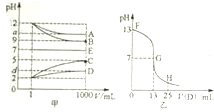 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.
(1)根据pH的变化关系,写出物质的化学式:BNaOH,CHCl.
(2)写出A与C反应的离子方程式:NH3+H+=NH4+.
(3)图乙为室温时向25mL某浓度的B溶液中逐滴滴加0.2mol.L-1的D溶液的过程中pH的变化曲线.
①图乙中B的物质的量浓度为0.1mol.L-1
②G点溶液呈中性,则二者恰好完全反应的点是在FG(填FG、GH)区间.
③G点溶液中各离子浓度大小关系是c(Na+)=c(CH3COO-)>c(H+)=c(OH-).
(4)t℃时,A的稀溶液中c(H+)=10-amol.L-1,c(OH-)=10-bmol.L-1,已知a+b=13,该温度下(t℃),将100mL0.2mol.L-1的C溶液与100mL0.4mol.L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH=12.
 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
(2)写出A与C反应的离子方程式:NH3+H+=NH4+.
(3)图乙为室温时向25mL某浓度的B溶液中逐滴滴加0.2mol.L-1的D溶液的过程中pH的变化曲线.
①图乙中B的物质的量浓度为0.1mol.L-1
②G点溶液呈中性,则二者恰好完全反应的点是在FG(填FG、GH)区间.
③G点溶液中各离子浓度大小关系是c(Na+)=c(CH3COO-)>c(H+)=c(OH-).
(4)t℃时,A的稀溶液中c(H+)=10-amol.L-1,c(OH-)=10-bmol.L-1,已知a+b=13,该温度下(t℃),将100mL0.2mol.L-1的C溶液与100mL0.4mol.L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH=12.
3.在无色透明溶液,可大量共存的离子是( )
| A. | K+ Na+ OH- SO42- | B. | OHˉ SO42- Al3+ Cl- | ||
| C. | H+ Na+ CO32- Cl- | D. | K+ Na+ NO3- Cu2+ |
10.合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是②③(填序号).
①反应压强为20Mpa~50Mpa
②500℃的高温
③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中.
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度).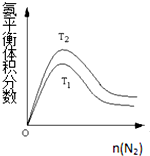
则T2T2<T1T1(填>、=、<),判断的依据是:合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T2<T1.
(3)合成氨气所需的氢气可以由水煤气分离得到.涉及反应信息如下:
反应一:C(s)+H2O(g)?H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K2
①K1的表达式:K1=$\frac{c(H2)c(CO)}{c(H2O)}$.
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为0.16mol•L-1•min-1.
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为D(填序号)
A.其它条件不变温度T<900℃
B.其它条件不变温度T>900℃
C.充入一定量氖气
D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2减小(填“增大”、“减小”或“不变”).
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是②③(填序号).
①反应压强为20Mpa~50Mpa
②500℃的高温
③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中.
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度).

则T2T2<T1T1(填>、=、<),判断的依据是:合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T2<T1.
(3)合成氨气所需的氢气可以由水煤气分离得到.涉及反应信息如下:
反应一:C(s)+H2O(g)?H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K2
①K1的表达式:K1=$\frac{c(H2)c(CO)}{c(H2O)}$.
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为D(填序号)
A.其它条件不变温度T<900℃
B.其它条件不变温度T>900℃
C.充入一定量氖气
D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2减小(填“增大”、“减小”或“不变”).
20.下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
| A. | 通过蒸发结晶稀硫酸的方式可以除去混合物NaCl(Na2CO3)中的Na2CO3,可提纯得到NaCl | |
| B. | 通过点燃O2的方式可以除去混合物CO2(CO)中的CO,可提纯得到CO2 | |
| C. | 通过过滤稀盐酸的方式可以除去混合物Zn(Ag)中的Ag,可提纯得到Zn | |
| D. | 通过蒸馏的方式可以除去混合物自来水(Cl-)中的Cl-,从而提纯得到自来水 |
7.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 18 g水中所含的电子数为10NA | |
| B. | 在标准状况下,1mol水的体积约为22.4L | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 11.2L氮气中含NA个氮原子 |
4.将碘水中的碘萃取出来的实验中,下列说法错误的是( )
| A. | 分液漏斗使用前要检查它是否漏水 | |
| B. | 萃取剂要求不溶于水,且比水更容易使碘溶解 | |
| C. | 分液时,下层液体应从下口流出,上层液体应从上口倒出 | |
| D. | 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后,不必静置,应立即分液 |
5.下列叙述中正确的是( )
| A. | 能导电的物质就是电解质 | |
| B. | 离子反应一定使溶液中所有离子的浓度都发生变化 | |
| C. | 复分解型离子反应必须具备有沉淀、气体、难电离的物质中之一的条件才能发生 | |
| D. | 酸碱中和反应都能用离子方程式:H++OH-=H2O表示 |