题目内容
16.已知常温下,溶液中能发生如下反应:①16H++10Z-+2XO4-═2X2++5Z2+8H2O②2M2++R2═2M3++2R- ③2R-+Z2═R2+2Z-由此判断,下列说法中正确的是( )| A. | Z2+2M2+═2M3++2Z-不可以进行 | |
| B. | Z元素在①③反应中发生还原反应 | |
| C. | 各粒子还原性由强到弱的顺序是X2+>Z->R->M2+ | |
| D. | 各粒子氧化性由强到弱的顺序是XO4->Z2>R2>M3+ |
分析 ①16H++10Z-+2XO4-═2X2++5Z2+8H2O中,Z元素的化合价升高,X元素的化合价降低;②2M2++R2═2M3++2R-中,M元素的化合价升高,R元素的化合价降低;③2R-+Z2═R2+2Z-中,Z元素的化合价降低,R元素的化合价升高,结合氧化还原反应基本概念及氧化剂的氧化性大于氧化产物的氧化性、还原剂的还原性大于还原产物的还原性来解答.
解答 解:A.根据还原性顺序:Z-<M2+,常温下可发生反应2M2++Z2═2M3++2Z-,故A错误;
B.反应①16H++10Z-+2XO4-=2X2++5Z2+8H2O中,Z元素化合价升高,被氧化发生氧化反应,在反应③2R-+Z2═R2+2Z-中,Z元素化合价降低,被还原发生还原反应,故B错误;
C.根据反应2M2++R2═2M3++2R-,可得还原性顺序是:R-<M2+,根据反应2R-+Z2═R2+2Z-,可得还原性顺序是Z-<R-,根据反应:16H++10Z-+2XO4-=2X2++5Z2+8H2O,可得还原性顺序是:X2+<Z-,即还原性强弱顺序为:X2+<Z-<R-<M2+,故C错误;
D.氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,反应①16H++10Z-+2XO4-=2X2++5Z2+8H2O中,氧化性XO4->Z2;反应②2M2++R2═2M3++2R-中,氧化性R2>M3+;反应-③2R-+Z2═R2+2Z-中,氧化性:Z2>R2,即氧化性顺序是XO4->Z2>R2>M3+,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及氧化性、还原性比较的考查,题目难度不大.

练习册系列答案
相关题目
6.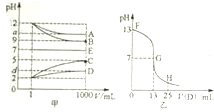 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.
(1)根据pH的变化关系,写出物质的化学式:BNaOH,CHCl.
(2)写出A与C反应的离子方程式:NH3+H+=NH4+.
(3)图乙为室温时向25mL某浓度的B溶液中逐滴滴加0.2mol.L-1的D溶液的过程中pH的变化曲线.
①图乙中B的物质的量浓度为0.1mol.L-1
②G点溶液呈中性,则二者恰好完全反应的点是在FG(填FG、GH)区间.
③G点溶液中各离子浓度大小关系是c(Na+)=c(CH3COO-)>c(H+)=c(OH-).
(4)t℃时,A的稀溶液中c(H+)=10-amol.L-1,c(OH-)=10-bmol.L-1,已知a+b=13,该温度下(t℃),将100mL0.2mol.L-1的C溶液与100mL0.4mol.L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH=12.
 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如甲图所示,其中A与D反应得到E.请回答下列问题.| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
(2)写出A与C反应的离子方程式:NH3+H+=NH4+.
(3)图乙为室温时向25mL某浓度的B溶液中逐滴滴加0.2mol.L-1的D溶液的过程中pH的变化曲线.
①图乙中B的物质的量浓度为0.1mol.L-1
②G点溶液呈中性,则二者恰好完全反应的点是在FG(填FG、GH)区间.
③G点溶液中各离子浓度大小关系是c(Na+)=c(CH3COO-)>c(H+)=c(OH-).
(4)t℃时,A的稀溶液中c(H+)=10-amol.L-1,c(OH-)=10-bmol.L-1,已知a+b=13,该温度下(t℃),将100mL0.2mol.L-1的C溶液与100mL0.4mol.L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH=12.
7.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 18 g水中所含的电子数为10NA | |
| B. | 在标准状况下,1mol水的体积约为22.4L | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 11.2L氮气中含NA个氮原子 |
4.将碘水中的碘萃取出来的实验中,下列说法错误的是( )
| A. | 分液漏斗使用前要检查它是否漏水 | |
| B. | 萃取剂要求不溶于水,且比水更容易使碘溶解 | |
| C. | 分液时,下层液体应从下口流出,上层液体应从上口倒出 | |
| D. | 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后,不必静置,应立即分液 |
11.下列实验能成功的( )
| A. | 乙醇和浓硫酸加热到140℃制取乙烯 | |
| B. | 乙烷和氯气光照下制取纯净的氯乙烷 | |
| C. | 在苯和溴水的混合物中加入铁粉制取溴苯 | |
| D. | 用酸性高锰酸钾溶液区分 和 和 |
1.下列离子方程式书写正确的是( )
| A. | 铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag | |
| B. | 硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 小苏打投入过量的澄清石灰水中 HCO3-+Ca2++OH-=CaCO3↓+H2O |
8.铀主要有两种同位素,关于${\;}_{92}^{235}U$的说法正确的是( )
| A. | 质子数为92 | B. | 中子数为235 | C. | 核外电子数为143 | D. | 质量数为92 |
5.下列叙述中正确的是( )
| A. | 能导电的物质就是电解质 | |
| B. | 离子反应一定使溶液中所有离子的浓度都发生变化 | |
| C. | 复分解型离子反应必须具备有沉淀、气体、难电离的物质中之一的条件才能发生 | |
| D. | 酸碱中和反应都能用离子方程式:H++OH-=H2O表示 |
 依据叙述,写出下列反应的热化学方程式.
依据叙述,写出下列反应的热化学方程式.