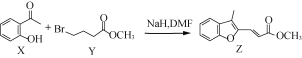题目内容
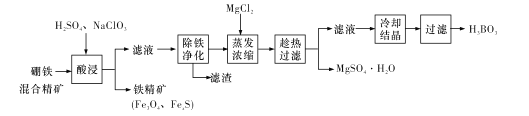
【题目】硼铁混合精矿含有硼镁石[MgBO2(OH)、磁铁矿(Fe3O4)、磁黄铁矿(FexS)、品质铀矿(UO2)等,以该矿为原料制备MgSO4·H2O和硼酸(H3BO3)的工艺流程如下:
已知:![]() 在pH为4~5的溶液中生成UO2(OH)2沉淀。
在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(l)“酸浸”时,为了提高浸出率可采取的措施有:________ (至少答两个措施),该步骤中NaC1O3可将UO2转化为![]() ,则该反应的离子方程式为_____。
,则该反应的离子方程式为_____。
(2)“除铁净化”需要加入____(填化学式)把溶液pH调节至4~5,滤渣的成分是_______。
(3)“蒸发浓缩”时,加入固体MgC12的作用是 ___。
(4)铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
![]() ,
,![]() ,
,![]() 回答下列问题:
回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:![]() ,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
②在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的c(Fe2+)/c(Fe3+)会 __(填“变大”“变小”或“不变”),请结合相关数据推理说明:____。
【答案】搅拌、升高温度、延长浸出时间、适当提高硫酸的浓度,将硼铁矿粉碎等(任选两种) 3UO22++6H++ClO3-=UO22++3H2O+Cl- MgO或Mg(OH)2 Fe(OH)3、UO2(OH)2 增大镁离子浓度,有利于析出MgSO4H2O 2.5×10(37-3a) 变大 ![]() =
=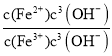 =
=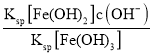 =
=![]() =2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则
=2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则![]() 变大
变大
【解析】
硼铁混合精矿含有硼镁石[MgBO2(OH)]、磁铁矿(Fe3O4)、磁黄铁矿(FexS)、晶质铀矿(UO2)等,加入硫酸、NaClO3,NaClO3可将UO2转化为UO22+,过滤除去少量铁精矿(Fe3O4、FexS),滤液调节pH除铁净化,可生成氢氧化铁、UO2(OH)2沉淀,过滤后的溶液中加入氯化镁,进行蒸发浓缩,趁热过滤可得到硫酸镁晶体,滤液中含有硼酸,冷却结晶得到硼酸(H3BO3)晶体,据此分析解答。
(1)酸浸”时,为了提高浸出率可采取的措施有:搅拌、升高温度、延长浸出时间、适当提高硫酸的浓度,将硼铁矿粉碎等;NaClO3可将UO2转化为UO22+,反应的离子方程式为3UO22++6H++ClO3-=UO22++3H2O+Cl-,故答案为:搅拌、升高温度、延长浸出时间、适当提高硫酸的浓度,将硼铁矿粉碎等; 3UO22++6H++ClO3-=UO22++3H2O+Cl-;
(2)除铁净化时,应调节pH,为避免引入新杂质,可加入MgO或Mg(OH)2等,生成沉淀为Fe(OH)3、UO2(OH)2,故答案为:MgO或Mg(OH)2;Fe(OH)3、UO2(OH)2;
(3)“蒸发浓缩”时,加入固体MgCl2,可使溶液中镁离子浓度增大,有利于析出MgSO4H2O,故答案为:增大镁离子浓度,有利于析出MgSO4H2O;
(4)①在T℃, Fe3+水解方程式为![]() ,则该条件下Fe3+水解反应的平衡常数K=
,则该条件下Fe3+水解反应的平衡常数K=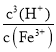 =
=![]() =
=![]() =2.5×10(37-3a),故答案为:2.5×10(37-3a);
=2.5×10(37-3a),故答案为:2.5×10(37-3a);
(4)铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
![]() 回答下列问题:
回答下列问题:
②![]() =
=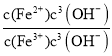 =
=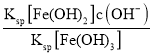 =
=![]() =2.0×1022×c(OH-),在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体,溶液中的c(OH-)增大,则
=2.0×1022×c(OH-),在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体,溶液中的c(OH-)增大,则![]() 变大,故答案为:变大;
变大,故答案为:变大;![]() =
=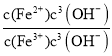 =
=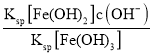 =
=![]() =2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则
=2.0×1022×c(OH-),加入少量NaOH固体,溶液中的c(OH-)增大,则![]() 变大。
变大。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】下列分子中,各分子的空间构型、中心原子的杂化方式以及孤电子对数均正确的是
选项 | 分子 | 空间构型 | 杂化方式 | 孤电子对数 |
A | NH3 | 平面三角形 | sp3杂化 | N含有一对孤电子对 |
B | CCl4 | 正四面体 | sp3杂化 | C不含有孤电子对 |
C | H2O | V形 | sp2杂化 | O含有两对孤电子对 |
D | CO32- | 三角锥形 | sp3杂化 | C含有一对孤电子对 |
A. AB. BC. CD. D