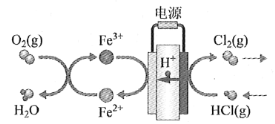
题目内容
【题目】A、B、C均为短周期元素,它们在周期表中的位置如下图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B.C两元素的核电荷数之和是A元素原子序数的4倍。下列说法正确的是
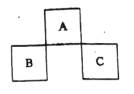
A.C位于元素周期表中第3周期第VA族
B.B的非金属性比A强
C.C的气态氢化物的稳定性比B的强
D.原子半径:r(B)<r(C)
【答案】C
【解析】
A、B、C均为短周期元素,设A的原子序数为x,由图可知,A为第二周期,B、C在第三周期,
B的原子序数为x+7,C的原子序数为x+9,
由B、C两元素的核电荷数之和是A元素原子序数的4倍,
则x+7+x+9=4x,
解得x=8,
则A为O,B为P,C为Cl,
A. C位于元素周期表中第3周期第VIIA族,故A错误;
B. B是P,A为O,非金属性是O的强,故B错误;
C. C为Cl,B为P,同一周期非金属性从左到右逐渐增强,所以气态氢化物的稳定性C比B强,故C正确;
D. 原子半径:同一周期原子半径从左到右逐渐减少,所以r(B)>r(C),故D错误;
故选:C。

练习册系列答案
相关题目