题目内容
【题目】下列混合物中可用分液漏斗分离,且有机物应从分液漏斗上口倒出的是 ( )
A.![]() 、Br2
、Br2
B.CH3Cl、H2O
C.CCl4、CHCl3
D.CH2Br—CH2Br、NaBr(H2O)
【答案】B
【解析】
A. ![]() 、Br2两者互溶,不能用分液漏斗,故A不符合题意;
、Br2两者互溶,不能用分液漏斗,故A不符合题意;
B. CH3Cl、水不互溶,可用分液漏斗分离,CH3Cl密度比水小,因此应从分液漏斗上口倒出,故B符合题意;
C. CCl4、CHCl3,两者互溶,不能用分液漏斗分离,故C不符合题意;
D. CH2Br—CH2Br、NaBr(H2O),两者不溶,可用分液漏斗分离,但CH2Br—CH2Br密度比水大,因此应从分液漏斗下口流出,故D不符合题意。
综上所述,答案为B。

【题目】利用太阳能、风能、生物质能等可再生能源,转化利用二氧化碳设计出适合高效清洁的合成燃料分子结构,实现CO2+H2O→CxHy的分子转化,生产合成甲烷、醇醚燃料、烷烃柴油、航空燃油等可再生合成燃料。因此二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1=-206.2kJ/mol
CH4(g)+H2O(g) △H1=-206.2kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2
CO2(g)+H2(g) H2
若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则△H2=__。
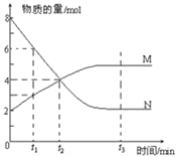
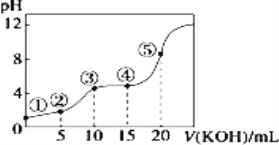
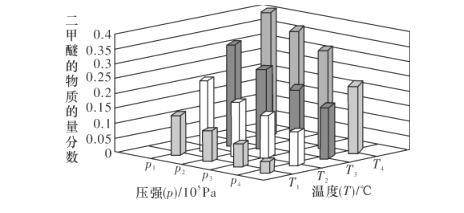
(2)合成二甲醚的总反应为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
(3)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①该反应△H__(填“>”“<”或“=”)0。
②下列叙述能说明此反应达到平衡状态的是__(填字母代号)。
a.混合气体的平均相对分子质量保持不变
b.1molCO2生成的同时有3molH-H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)% | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
CH3OH的产 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为__催化效果最佳。
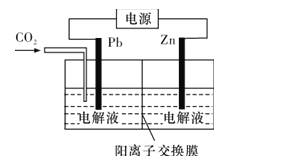
(4)CO2可用于工业制备草酸锌,其原理如图所示(电解液不参加反应),Zn电极是__极。已知在Pb电极区得到ZnC2O4,则Pb电极上的电极反应式为__。