题目内容
【题目】常温下,用 0.10 mol/LKOH 溶液滴定 10.00mL 0.10 mol/L 某二元弱酸H2R 溶液,滴定曲线如图(混合溶液总体积看作混合前两种溶液体积之和),下列关系不正确的是
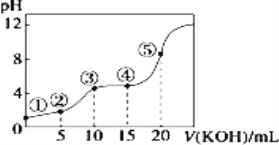
A.点②所示溶液中:c(K+)+c(H+)=c(HR-)+2c(R2-)+c(OH-)
B.点③所示溶液中:c(K+)> c(HR-)> c(R2-)>c(H2R)
C.点④所示溶液中:c(H2R)+ c(HR-)+ c(R2-)=0.04mol·L-1
D.点⑤所示溶液中:c(H+)= c(HR-)+2 c(H2R)+ c(OH-)
【答案】D
【解析】
A. 点②所示溶液中溶质为KHR 和H2R,两者浓度相同,根据溶液中电荷守恒得到c(K+) + c(H+) = c(HR-) + 2c(R2) + c(OH-),故A正确;
B. 点③所示溶液中溶质为KHR,溶液显酸性,电离为主,因此有c(K+)> c(HR-)> c(R2)> c(H2R),故B正确;
C. 点④所示溶液中溶质为KHR和K2R,两者浓度相同,溶液显酸性,电离为主,因此根据物料守恒得到:c(H2R)+ c(HR-)+ c(R2) =![]() ,故C正确;
,故C正确;
D. 点⑤所示溶液中溶质为K2R,根据质子守恒得到:c(OH-) = c(H+) + c(HR-) +2 c(H2R),故D错误。
综上所述,答案为D。

练习册系列答案
相关题目