题目内容
【题目】利用太阳能、风能、生物质能等可再生能源,转化利用二氧化碳设计出适合高效清洁的合成燃料分子结构,实现CO2+H2O→CxHy的分子转化,生产合成甲烷、醇醚燃料、烷烃柴油、航空燃油等可再生合成燃料。因此二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1=-206.2kJ/mol
CH4(g)+H2O(g) △H1=-206.2kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2
CO2(g)+H2(g) H2
若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则△H2=__。
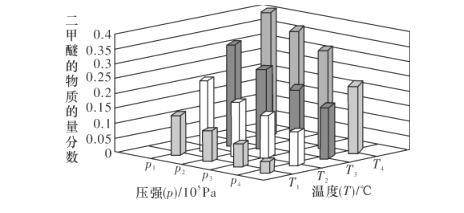
(2)合成二甲醚的总反应为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
(3)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①该反应△H__(填“>”“<”或“=”)0。
②下列叙述能说明此反应达到平衡状态的是__(填字母代号)。
a.混合气体的平均相对分子质量保持不变
b.1molCO2生成的同时有3molH-H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)% | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
CH3OH的产 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为__催化效果最佳。
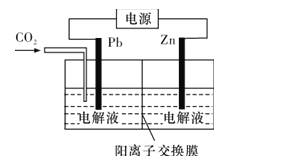
(4)CO2可用于工业制备草酸锌,其原理如图所示(电解液不参加反应),Zn电极是__极。已知在Pb电极区得到ZnC2O4,则Pb电极上的电极反应式为__。
【答案】-41.2kJ/mol > < 57.1% < ab 60 阳 2CO2+2e-==C2O42-
【解析】
(1)由“若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ”,我们可写出热化学方程式为:CO2(g)+4H2(g)==CH4(g)+2H2O(g) △H=-165.0kJ/mol,利用盖斯定律,可求出△H2。
(2)正反应为放热的体积缩小的可逆反应,依据平衡移动原理,增大压强、降低温度,平衡都正向移动,提取图中信息,便可得出p1与p2、K3与K4关系及T1、p1时H2的平衡转化率。
(3)①利用H-TS<0,可判断该反应的△H与0的关系。
②a.混合气体的平均相对分子质量保持不变,则气体的总物质的量不变;
b.1molCO2生成的同时有3molH-H键断裂,反应的方向相反,数值之比等于化学计量数之比;
c.对于该反应,CO2的转化率和H2的转化率始终相等;
d.对于该反应,混合气体的密度始终保持不变。
③由表中数据,可确定CuO的催化效果的最佳点。
(4)因为在Pb电极区得到ZnC2O4,则表明Pb电极上CO2得电子,作阴极,由此可确定Zn电极作电解池的电极名称,并可写出Pb电极上的电极反应式。
(1)由“若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ”,我们可写出热化学方程式为:
CO2(g)+4H2(g)==CH4(g)+2H2O(g) △H=-165.0kJ/mol ①
CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1=-206.2kJ/mol ②
CH4(g)+H2O(g) △H1=-206.2kJ/mol ②
利用盖斯定律,将②-①,即得CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=-41.2kJ/mol。答案为:-41.2kJ/mol;
CO2(g)+H2(g) H2=-41.2kJ/mol。答案为:-41.2kJ/mol;
(2)合成二甲醚的总反应为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1,
CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1,
正反应为放热的体积缩小的可逆反应,依据平衡移动原理,增大压强,平衡正向移动;降低温度,平衡正向移动,平衡常数增大。提取图中信息,p1、T4时,二甲醚的物质的量分数大,所以p1>p2,T3>T4,则K3<K4。从图中可以看出,T1、p1时,二甲醚的物质的量分数为0.1,假设某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,CO2的变化量为2x,三段式为:

则![]() ,x=
,x=![]() mol,H2的平衡转化率为
mol,H2的平衡转化率为![]() =57.1%。答案为:>;<;57.1%;
=57.1%。答案为:>;<;57.1%;
(3) ①S<0,利用H-TS<0,可判断该反应的△H<0。答案为:<;
②a.混合气体的平均相对分子质量保持不变,则气体的总物质的量不变,表明反应达平衡状态,a符合题意;
b.1molCO2生成的同时有3molH-H键断裂,反应的方向相反,数值之比等于化学计量数之比,表明反应达平衡状态,b符合题意;
c.对于该反应,反应物的起始投入量之比等于化学计量数之比,所以不管反应进行到什么程度,CO2的转化率和H2的转化率始终相等,则反应不一定达平衡状态,c不合题意;
d.对于该反应,混合气体的质量与体积都不变,所以密度始终保持不变,反应不一定达平衡状态,d不合题意。答案为:ab;
③由表可知,CuO的质量分数为60%时,CH3OH的产率、CO2的转化率都达最大值,催化效果最佳。答案为:60; (4)因为在Pb电极区得到ZnC2O4,则表明Pb电极上CO2得电子,Zn电极失电子作阳极;在阴极,CO2得电子生成C2O42-,与从阳极区通过阳离子交换膜迁移的Zn2+在阴极区发生反应生成ZnC2O4,电极反应式为2CO2+2e-==C2O42-。答案为:阳;2CO2+2e-==C2O42-。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】下列实验不能达到目的的是( )
选项 | 目的 | 实验 |
A | 制取较高浓度的次氯酸溶液 | 将Cl2通入小苏打溶液中 |
B | 除去溴苯中的少量溴 | 加入苛性钠溶液洗涤、分液 |
C | 加快氢气的生成速率 | 将与稀硫酸反应的粗锌改为纯锌 |
D | 制备少量氨气 | 向新制生石灰中滴加浓氨水 |
A.AB.BC.CD.D
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )

A.Ⅰ曲线代表HClO,Ⅱ曲线代表CH3COOH
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O=HClO+CO32-
C.图象中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的总浓度大于b点酸的总浓度