题目内容
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
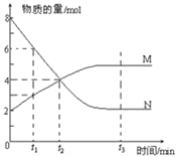
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
【答案】2N(g)M(g) t3 = 2∶1 能 AD 0.125molL-1s-1 1mol/L
【解析】
(1)由图可知,N减少,M增加,并利用量的变化来分析书写反应的方程式;
(2)根据化学平衡状态的特征分析判断平衡点,平衡时正逆反应速率相等,化学反应中反应速率之比等于化学计量数之比;
(3)根据反应前后气体的化学计量数关系判断压强是否对平衡产生影响;
(4)从外界条件对反应速率的影响分析判断;
(5)根据v=![]() 求出v(SO2),再利用速率之比等于化学计量数之比,计算v(O2);根据方程式,计算出SO3的物质的量,再利用c=
求出v(SO2),再利用速率之比等于化学计量数之比,计算v(O2);根据方程式,计算出SO3的物质的量,再利用c=![]() 计算SO3的物质的量浓度。
计算SO3的物质的量浓度。
(1)由图可知,N的物质的量减少8mol-2mol=6mol,M增加5mol-2mol=3mol,N为反应物,M为生成物,且变化量之比为2∶1,即化学计量数之比为2∶1,反应的方程式为2N (g)M (g),故答案为:2N (g)M (g);
(2)因物质的量随时间的变化而不发生变化时为平衡状态,由图可知,t3为平衡状态,且平衡时正逆反应速率相等,由化学反应中反应速率之比等于化学计量数之比,则v(N)∶v(M)=2∶1,故答案为:t3;=;2∶1;
(3)反应的化学方程式为2N (g)M (g),反应前后气体的化学计量数不等,则当反应处于平衡状态时,压强不再改变,故答案为:能;
(4)A.升高温度,反应速率增大,故A正确;B.降低压强,反应物浓度减小,反应速率减小,故B错误;C.减小M的浓度,反应速率减小,故C错误;D.将反应容器体积缩小,反应物的浓度增大,则反应速率增大,故D正确;故答案为:AD;
(5)以SO2表示的该反应的速率v(SO2)=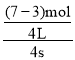 =0.25molL-1s-1,速率之比等于化学计量数之比,所以v(O2)=
=0.25molL-1s-1,速率之比等于化学计量数之比,所以v(O2)=![]() v(SO2)=
v(SO2)=![]() ×0.25molL-1s-1=0.125molL-1s-1;参加反应的SO2的物质的量为7mol-3mol=4mol,根据方程式2SO2(g)+O2(g)2SO3(g)可知,生成的SO3的物质的量等于参加反应的SO2的物质的量,平衡时SO3的物质的量浓度为c(SO3)=
×0.25molL-1s-1=0.125molL-1s-1;参加反应的SO2的物质的量为7mol-3mol=4mol,根据方程式2SO2(g)+O2(g)2SO3(g)可知,生成的SO3的物质的量等于参加反应的SO2的物质的量,平衡时SO3的物质的量浓度为c(SO3)=![]() =1mol/L,故答案为:0.125molL-1s-1;1mol/L。
=1mol/L,故答案为:0.125molL-1s-1;1mol/L。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:
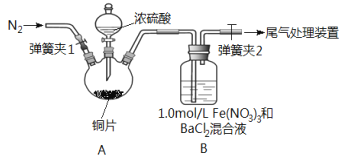
(1)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为__________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加,不考虑体系残留的氧气);
假设1:装置A中白雾进入装置B中参与了反应;
假设2:________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 ③______________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生氧化还原反应的离子方程式:_________。
【题目】全钒液流电池是一种新型的绿色环保储能系统,工作原理如图:
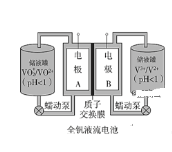
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是__________。
(2)当完成储能时,正极溶液的颜色是________
(3)质子交换膜的作用是____________
【题目】下列实验不能达到目的的是( )
选项 | 目的 | 实验 |
A | 制取较高浓度的次氯酸溶液 | 将Cl2通入小苏打溶液中 |
B | 除去溴苯中的少量溴 | 加入苛性钠溶液洗涤、分液 |
C | 加快氢气的生成速率 | 将与稀硫酸反应的粗锌改为纯锌 |
D | 制备少量氨气 | 向新制生石灰中滴加浓氨水 |
A.AB.BC.CD.D




