题目内容
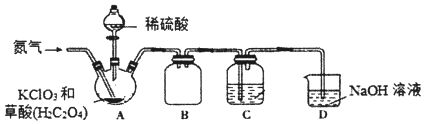
【题目】A、B、C、D四种有机物分子中的碳原子数目相同,标准状况下烃A对氢气的相对密度是13;烃B跟HBr反应生成C;C与D混合后加入NaOH并加热,可生成B。
(1)写出有机物的结构简式:A____;D____。
(2)写出有关反应的化学方程式:____。
【答案】CH![]() CH CH3CH2OH CH2=CH2 + HBr
CH CH3CH2OH CH2=CH2 + HBr ![]() CH3CH2Br,CH3CH2Br + NaOH
CH3CH2Br,CH3CH2Br + NaOH![]() CH2=CH2↑+ NaBr + H2O
CH2=CH2↑+ NaBr + H2O
【解析】
A、B、C、D四种有机物分子中的碳原子数目相同,标准状况下烃A对氢气的相对密度是13,则A的摩尔质量为![]() ,则M=26gmol-1,A的相对分子质量为26,除以12得到碳的原子数目和氢原子数目,因此A的分子式为C2H2,烃B跟HBr反应生成C,因此B为C2H4,为乙烯CH2=CH2,则C为CH3CH2Br,C与D混合后加入NaOH并加热,可生成B,C发生消去反应,D为乙醇CH3CH2OH。
,则M=26gmol-1,A的相对分子质量为26,除以12得到碳的原子数目和氢原子数目,因此A的分子式为C2H2,烃B跟HBr反应生成C,因此B为C2H4,为乙烯CH2=CH2,则C为CH3CH2Br,C与D混合后加入NaOH并加热,可生成B,C发生消去反应,D为乙醇CH3CH2OH。
(1)根据上面分析得出有机物的结构简式:A.CH![]() CH;D. CH3CH2OH,故答案为:CH
CH;D. CH3CH2OH,故答案为:CH![]() CH;CH3CH2OH。
CH;CH3CH2OH。
(2)写出有关反应的化学方程式:CH2=CH2 + HBr ![]() CH3CH2Br,CH3CH2Br + NaOH
CH3CH2Br,CH3CH2Br + NaOH![]() CH2=CH2↑+ NaBr + H2O,故答案为:CH2=CH2 + HBr
CH2=CH2↑+ NaBr + H2O,故答案为:CH2=CH2 + HBr ![]() CH3CH2Br;CH3CH2Br + NaOH
CH3CH2Br;CH3CH2Br + NaOH![]() CH2=CH2↑+ NaBr + H2O。
CH2=CH2↑+ NaBr + H2O。

【题目】已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:
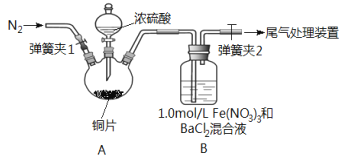
(1)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为__________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加,不考虑体系残留的氧气);
假设1:装置A中白雾进入装置B中参与了反应;
假设2:________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 ③______________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生氧化还原反应的离子方程式:_________。
【题目】下列实验不能达到目的的是( )
选项 | 目的 | 实验 |
A | 制取较高浓度的次氯酸溶液 | 将Cl2通入小苏打溶液中 |
B | 除去溴苯中的少量溴 | 加入苛性钠溶液洗涤、分液 |
C | 加快氢气的生成速率 | 将与稀硫酸反应的粗锌改为纯锌 |
D | 制备少量氨气 | 向新制生石灰中滴加浓氨水 |
A.AB.BC.CD.D