题目内容
【题目】镍及其化合物在工业生产中有着广泛的运用,当前世界上镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍元素在元素周期表中位于__________,在基态镍原子中,其核外电子有_______种不同运动状态,M层电子排布式为______________________。
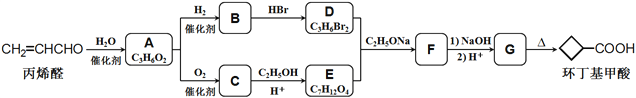
(2)在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。在该结构中,氮镍之间形成的化学键是__________,碳原子的杂化轨道类有_______________,非金属元素的电负性由大到小的顺序是_________________。
(3)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18) =Cr的价电子数(6)+CO提供电子数(2×6)。Ni原子与CO形成配合物的化学式为______________。该配合物常温下为液态,易溶于CCl4、苯等有机溶剂,据此判断该分子属于____________分子(填“极性”或“非极性”)。
(4)甲醛在Ni催化作用下加氢可得甲醇。甲醇分子内的O-C-H键角_____________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是______________。
(5)NixO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm.晶胞中两个Ni原子之间的最短距离为_______pm。若晶体中的Ni离子分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为____________。
【答案】第四周期第Ⅷ族 28 3s23p63d8 配位键 sp2、sp3 O>N>C>H Ni(CO)4 非极性 小于 甲醇分子和水分子间能够形成氢键,且甲醇和水都是极性分子 ![]() a 8:3
a 8:3
【解析】
(1)Ni的原子序数28,位于第四周期、Ⅷ族元素,题目中问的是M层电子的排布;
(2)从图看出氮镍之间形成的是配位键;碳原子的价层电子对数有等于3,也有等于4,故碳原子的杂化类型为sp2杂化、sp3杂化,H、C、N、O的电负性的比较,同一周期从左到右主族元素的电负性逐渐增强;
(3)依据题中所给配合物价电子总数符合18电子规则,镍元素的价电子数为10,可以推出Ni原子与CO形成配合物的化学式为Ni(CO)4;根据相似相溶原理,判断出Ni(CO)4为非极性分子
(4)甲醇分子内C的成键电子对数为4,无孤电子对,杂化类型为sp3,甲醛分子中的碳采取sp2杂化,甲醇分子内O-C-H键角比甲醛分子内O-C-H键角小;依据相似相溶原理和分子间可以形成氢键,因此甲醇易溶于水;
(5)依据x的值和化合物中元素化合价代数和为0,可以计算出Ni2+与Ni3+的最简整数比。
(1)Ni的原子序数28,位于第四周期,Ⅷ族元素,根据泡利不相溶原理,核外有多少个电子就有多少种运动状态,所以镍原子核外有28种运动状态;
(2)从图看出氮镍之间形成的是配位键;碳原子形成四个单键是sp3杂化,形成一个双键和两个单键是sp2杂化;根据非金属性越强,电负性越小,则有O>N>C>H;
(3)镍元素的价电子数为10,根据18电子规则,它可以结合4个CO形成配合物,所以形成的配合物的化学式为Ni(CO)4。配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,由于四氯化碳和苯均是非极性分子,则根据相似相溶原理可知该分子属于非极性分子;(4)甲醇分子内C的成键电子对数为4,无孤电子对,杂化类型为sp3,是四面体结构,甲醛分子中的碳采取sp2杂化,是平面三角形结构,甲醇分子内O-C-H键角比甲醛分子内O-C-H键角小;由于甲醇分子和水分子间能够形成氢键,且甲醇和水都是极性分子,相似相溶,所以甲醇易溶于水;
(5)由于NixO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的1/2,由晶胞棱边长可得晶胞面对角线为长为:![]() a pm,则晶胞中两个Ni原子之间的最短距离为:
a pm,则晶胞中两个Ni原子之间的最短距离为:![]() a pm。设NixO晶体中含Ni2+与Ni3+的个数分别为x、y,根据题意列方程组:x+y=0.88,2x+3y=2,联立解得:x=0.64,y=0.24,所以x:y=0.64:0.24=8:3。
a pm。设NixO晶体中含Ni2+与Ni3+的个数分别为x、y,根据题意列方程组:x+y=0.88,2x+3y=2,联立解得:x=0.64,y=0.24,所以x:y=0.64:0.24=8:3。

【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
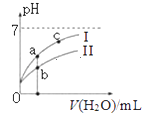
A.Ⅰ曲线代表HClO,Ⅱ曲线代表CH3COOH
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O=HClO+CO32-
C.图象中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的总浓度大于b点酸的总浓度