题目内容
7.设NA表示阿伏加德罗常数,下列说法不正确的是( )| A. | 1mol氯气参加氧化还原反应,转移的电子数一定为2 NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为4NA | |
| D. | 常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA |
分析 A、氯气参与反应时可能只做氧化剂被还原,也可能既做氧化剂又做还原剂,发生歧化反应;
B、等物质的量铁和氯气反应生成氯化铁,铁过量,反应的电子转移根据氯气计算;
C、质量换算物质的量结合二氧化碳分子结构计算共用电子数;
D、根据氧气和臭氧混合气体中含有的氧原子质量计算出氧原子的物质的量及含有的质子数目;
解答 解:A、氯气参与反应时可能只做氧化剂被还原,此时1mol氯气转移2mol电子;但氯气也可能既做氧化剂又做还原剂,发生歧化反应,如在与NaOH溶液的反应中:Cl2+2NaOH=NaCl+NaClO+H2O,1mol氯气参与反应时转移1mol电子,故A错误;
B、等物质的量铁和氯气反应生成氯化铁,铁过量,反应的电子转移根据氯气计算,转移电子数0.2NA,故B错误;
C、44g二氧化碳分子物质的量为1mol,二氧化碳结构为O=C=O,分子中所形成的共用电子对数为4NA,故C正确;
D、1.6g氧气和臭氧的混合气体中含有1.6g氧原子,含有0.1mol氧原子,含有的质子的物质的量为0.8mol,混合气体中含有质子总数为0.8NA,故D正确;
故选AB.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.去乙酸乙酯中含有的乙酸,最好的处理操作是( )
| A. | 蒸馏 | B. | 用过量氢氧化钠溶液洗涤后分液 | ||
| C. | 水洗后分液 | D. | 用过量饱和碳酸钠溶液洗涤后分液 |
15.羟基扁桃酸可由苯酚和乙醛酸通过一步反应制得,下列有关说法正确的是( )
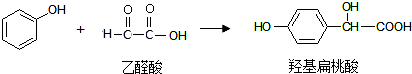

| A. | 羟基扁桃酸可以发生加成反应 | |
| B. | 上述反应属于取代反应 | |
| C. | 乙醛酸的核磁共振氢谱中有2个吸收峰 | |
| D. | 羟基扁桃酸能发生消去反应 |
2.关于下式表示的有机物的性质叙述中不正确的是( )


| A. | 它有酸性,能与纯碱溶液反应 | |
| B. | 它可以水解,水解产物只有一种 | |
| C. | 1 mol该有机物最多能和7 mol NaOH反应 | |
| D. | 该有机物能发生取代反应 |
12.下列物质中,既有离子键,又有非极性共价键的是( )
| A. | H2SO4 | B. | CaCl2 | C. | NH4Cl | D. | Na2O2 |
19.下列过程中,离子键被破坏的是( )
| A. | 干冰升华 | B. | KNO3熔化 | C. | NaCl溶于水 | D. | HCl气体溶于水 |
16. 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
(1)滴定管如图所示,用乙滴定管盛装0.2500mol/L氢氧化钠标准液 (填“甲”或“乙”).根据所给数据,该盐酸溶液的浓度为0.2632 mol/L
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选酚酞作指示剂,判断滴定终点的现象是滴入最后一滴标准液,溶液由无色变成浅红色,且半分钟内不恢复原来的颜色
(3)下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:| 实验编号 | 待测液体积/mL | 所消耗氢氧化钠标准液的体积/mL |
| 1 | 25.00 | 26.30 |
| 2 | 25.00 | 26.34 |
| 3 | 25.00 | 19.36 |
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选酚酞作指示剂,判断滴定终点的现象是滴入最后一滴标准液,溶液由无色变成浅红色,且半分钟内不恢复原来的颜色
(3)下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.

 .
.