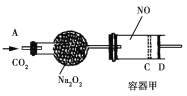
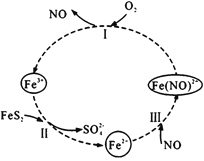
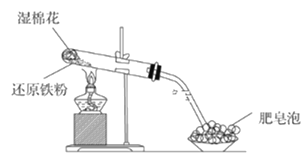
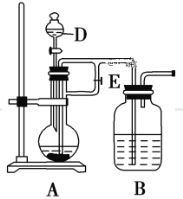
题目内容
【题目】某无色透明酸性溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-、NO3-中的若干种离子。某同学取50 mL的溶液进行如下实验:
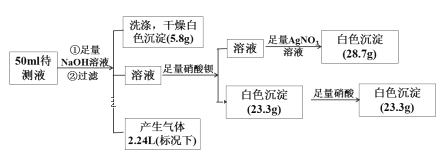
回答下列问题:
(1)原溶液中肯定存在的离子是____________ ,肯定不存在的离子是______________ 。
(2)原溶液中可能存在的离子是______________ 。
(3)原溶液中Cl-的浓度为______________ 。
(4)原溶液中c(K+)范围:_______________ (若不存在,说明理由)
【答案】NH4+、Mg2+、SO42-、Cl-、K+ Fe2+、Fe3+、Ba2+ NO3- 4mol/L c(K+)≥2mol/L
【解析】
无色溶液说明溶液中不含有有色离子Fe2+、Fe3+;由实验流程可知,向50 mL溶液加入足量氢氧化钠溶液,生成5.8g白色沉淀和2.24L气体,说明溶液中含有0.1mol Mg2+和0.1mol NH4+;向反应后的溶液中加入足量的硝酸钡溶液,生成23.3g白色沉淀,加入足量硝酸,沉淀没有溶解,说明溶液中含有0.1molSO42-,不含有Ba2+;再向反应后的溶液中加入足量硝酸银溶液,生成28.7g氯化银白色沉淀,说明溶液中含有0.2mol Cl-;由于实验中没有涉及NO3-的检验,溶液中可能存在NO3-;由溶液中阳离子为0.1mol Mg2+和0.1mol NH4+可知,阳离子电荷数为0.1mol×2+0.1mol=0.3mol,阴离子为0.1molSO42-、0.2mol Cl-和可能含有NO3-可知,阴离子电荷数≥0.1mol×2+0.2mol=0.4mol,由电荷守恒可知,溶液中一定存在K+。
(1)由以上分析可知原溶液中肯定存在的离子是NH4+、Mg2+、SO42-、Cl-、K+,肯定不存在的离子是Fe2+、Fe3+、Ba2+,故答案为:NH4+、Mg2+、SO42-、Cl-、K+;Fe2+、Fe3+、Ba2+;
(2)由于实验中没有涉及NO3-的检验,溶液中可能存在NO3-,故答案为:NO3-;
(3)由分析可知溶液中含有0.2mol Cl-,则50 mL溶液中Cl-的浓度为![]() =4mol/L,故答案为:4mol/L;
=4mol/L,故答案为:4mol/L;
(4)由电荷守恒可知,溶液中存在如下关系2n(Mg2+)+ n(NH4+)+ n(K+)≥2n(SO42-)+ n(Cl-),n(K+)≥0.4mol—0.3mol=0.1mol,则c(K+)≥![]() =1mol/L,故答案为:1mol/L。
=1mol/L,故答案为:1mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案