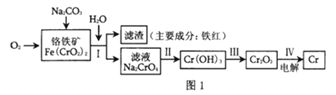
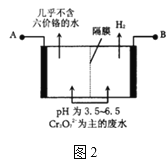
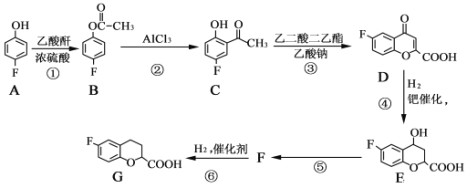
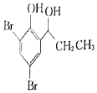
题目内容
【题目】I.红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据),根据下图回答下列问题:
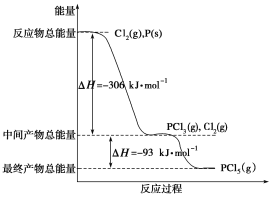
(1)PCl5分解生成PCl3和Cl2的热化学方程式____________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________________。
(3)P和Cl2分两步反应生成1molPCl5的ΔH3=____________。
Ⅱ.某学生做浓度对化学反应速率的影响的实验时,将2支试管编号为①②,并按下表中物质的量进行实验,记录的时间数据是:16s、28s。请将2个数据填入下表的适当位置,并写出实验结论。
试管编号 | 加入3%Na2S2O3 | 加H2O | 加稀盐酸(1∶5) | 出现浑浊时间 |
① | 3mL | 3mL | 5滴 | a._____s |
② | 4mL | 2mL | 5滴 | b._____s |
(1)将对应①②的时间分别写出:a.____________,b.____________。
(2)实验结论____________________________________。
(3)写出反应的化学方程式_______________________________________________。
【答案】PCl5(g)===PCl3(g)+Cl2(g)ΔH=+93kJ·mol-1 25% 大于 因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成 -399kJ·mol-1 28s 16s 反应物浓度越大,反应速率越快 Na2S2O3+2HCl=2NaCl+SO2↑+S↓+H2O
【解析】
I.(1)据图可知1molCl2(g)和1molPCl3(g)合成1molPCl5(g)需要释放93kJ热量;依据分解率=![]() ×100%计算PCl5的分解率;吸热反应,升高温度平衡向正向移动;
×100%计算PCl5的分解率;吸热反应,升高温度平衡向正向移动;
(2)根据化学平衡移动原理分析;
(3)根据盖斯定律计算解答;
Ⅱ.Na2S2O3在酸性环境下会发生歧化反应;两组实验的唯一变量为Na2S2O3的浓度,时间越短说明反应速率越大,据此判断浓度对反应速率的影响。
(1)结合分析可知1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJmol-1;在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,分解的PCl5为0.2mol,分解率=![]() ×100%=25%;PCl5分解的反应焓变大于0,为吸热反应,升高温度平衡向正向移动,所以分解率α2大于α1;
×100%=25%;PCl5分解的反应焓变大于0,为吸热反应,升高温度平衡向正向移动,所以分解率α2大于α1;
(2)因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成,所以工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5;
(3)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
①P(s)+![]() Cl2(g)=PCl3(g);△H1=-306 kJ/mol;
Cl2(g)=PCl3(g);△H1=-306 kJ/mol;
②Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;
依据盖斯定律可知:①+②得:P(s)+![]() Cl2(g)=PCl5(g),△H=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol;
Cl2(g)=PCl5(g),△H=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol;
Ⅱ.(1)反应物硫代硫酸钠的浓度②>①,其他条件相同,所以反应速率②>①,反应时间①>②,所以a=28s,b=16s;
(2)对于一个化学反应,在其他条件不变时,反应物浓度越大,反应速率越快;
(3)Na2S2O3在酸性环境下会发生歧化反应生成二氧化硫和硫单质,根据电子守恒和元素守恒可得方程式为Na2S2O3+2HCl=2NaCl+SO2↑+S↓+H2O。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】联合国大会将2019年定为“化学元素周期表国际年”,显示了元素周期律的重要性。下表列出了a~j10种元素在周期表中的位置:
周期 | IA | 0 | |||||||
1 | a | IIA | … | IIIA | IVA | VA | VIA | VIIA | |
2 | b | … | e | d | |||||
3 | c | f | … | g | h | i | j |
(1)因在元素b的电池材料领域做出了杰出贡献,97岁的古迪纳夫荣获2019年诺贝尔化学奖,b原子结构示意图为____;此类电池工作时,将___能转化为电能。
(2)a~j10种元素中,最外层电子数比K层电子数多的元素有___种(填数字);金属性最强的元素有_____(写元素符号)。
(3)元素g的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为:_______;
(4)h、i、j三种元素的气态氢化物中,最稳定的氢化物是______(写化学式);
(5)元素i的一种氧化物常用于漂白纸浆、草帽辫等。该氧化物具有还原性,在一定条件下能与常见氧化剂发生反应,写出其中一个反应的化学方程式:_______ 。
【题目】I.根据表格信息,请回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有____(填写字母序号)。
A.缩小反应容器的容积B.扩大反应容器的容积
C.升高温度D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。__________
Ⅱ.25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式__________