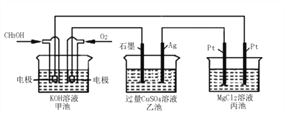
题目内容
【题目】太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为____________;
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能I1从大到小顺序为(用元素符号表示)_______________________________;用原子结构观点加以解释_________________________。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具 有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3NH3 。BF3NH3中B原子的杂化轨道类型为__________,N原子的杂化轨道类型为 ______________ ,B与 N之间形成 __________________ 键。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构;金刚砂晶体属于____________(填晶体类型)在SiC结构中,每个C原子周围最近的C原子数目为 ______________。
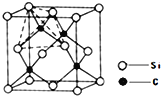
【答案】 [Ar]3d10 I1(Br)> I1(As)> I1(Se) 元素的第一电离能从左到右依次增大,而As原子最外层电子排布为4S24P3,P电子排布处于半充满状态,半充满状态更稳定,所以As元素的第一电离能比Se大。 sP3 sP3 配位 原子晶体 12
【解析】(1)考查电子排布式的书写,Cu位于第四周期IB族,因此Cu+的基态1s22s22p63d10或[Ar]3d10;(2)本题考查第一电离能的规律和洪特规则,非金属性越强,第一电离能越大,但IIA>IIIA、VA>VIA,因此第一电离能大小顺序是I1(Br)> I1(As)> I1(Se);当能级电子排布处于全满、半满、全空,则电子相对稳定,失去电子困难,元素的第一电离能从左到右依次增大,而As原子最外层电子排布为4s24p3,p能级上电子排布处于半充满状态,半充满状态更稳定,所以As元素的第一电离能比Se大;(3)考查杂化类型和化学键的类型,BF3中B有3个σ键,无孤电子对,B提供空轨道,NH3中N提供孤电子对,形成配位键,配位键为σ键,即B的σ键有4个,即杂化类型为sp3,B与N之间形成配位键;(4)本题考查晶体类型和晶体的结构,金刚石为原子晶体,晶体硅也为原子晶体,SiC是金刚石中一半的C原子换成Si,同种原子间不成键,因此SiC为原子晶体,根据SiC的结构,每个C原子周围最近的C原子数目为12。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案