题目内容
6.关于原子结构的叙述正确的是( )| A. | 原子的次外层电子数都是2 | |
| B. | 稀有气体原子的最外层电子数均为8 | |
| C. | 原子的最外层电子数不超过8个 | |
| D. | 所有的原子核都是由质子和中子组成的 |
分析 A、原子的次外层电子数可能是2、8、不超过18;
B、He只有2个电子;
C、根据核外电子排布规律判断理解;
D、氕的原子核都不含中子.
解答 解:A、原子含有2个电子层,原子的次外层电子数是2,原子含有3个电子层,原子的次外层电子数是8,原子的电子层为4或4个以上,次外层电子数最多不超过18个电子,故A错误;
B、稀有气体中氦只有一个电子层,只有2个电子,不满足8个电子,故B错误;
C、由于能级交错的原因,End>E(n+1)s.当ns和np充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd,而是首先形成新电子层,填入(n+1)s轨道中,因此最外层电子数不可能超过8个,即由核外电子排布规律可知原子的最外层电子数不超过8个,故C正确;
D、原子核一般由质子和中子构成,但氕的原子核都不含中子,只有1个质子,故D错误.
故选C.
点评 本题考查原子构成与核外电子排布规律,难度不大,注意原子结构的特殊性.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 原子的原子序数越大,原子半径越大 | |
| B. | 同族元素相差的原子序数可能为16、26、36、46 | |
| C. | I A族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 碱金属单质的熔点、沸点均随着原子序数的递增而升高 |
17.已知氯化铵的电子式 .下列有关氯化铵的叙述中,正确的是( )
.下列有关氯化铵的叙述中,正确的是( )
 .下列有关氯化铵的叙述中,正确的是( )
.下列有关氯化铵的叙述中,正确的是( )| A. | 属于离子化合物 | B. | 属于共价化合物 | C. | 只含有离子键 | D. | 只含有共价键 |
1.用分液漏斗不能分离的混合物是( )
| A. | 水和酒精 | B. | 溴乙烷和水 | C. | 溴苯和水 | D. | 苯和水 |
18.下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是( )
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Mg2+、NH4+、SO42-、K+ | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Ca2+、HCO3-、NH4+、AlO2- |
10.下列实验现象描述或说法不正确的是( )
| A. | 标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为$\frac{1}{22.4}$ mol/L | |
| B. | 氨很容易液化,因此氨常用作制冷剂 | |
| C. | SO3溶于水能导电,所以SO3是电解质 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |

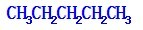 、
、 、
、 .
.