题目内容
15.下列说法正确的是( )| A. | 等质量的乙酸、葡萄糖与淀粉完全燃烧时消耗氧气的质量相等 | |
| B. | 醇、醛和羧酸都溶于水,烃与酯的密度都小于1g/cm3 | |
| C. | 豆浆中富含大豆蛋白,煮沸后蛋白质水解成了氨基酸 | |
| D. | 某烯烃(最简式为CH2)与H2加成产物为2,3-二甲基丁烷,则该烯烃可能有2种结构 |
分析 A.根据最简式分析,最简式相同,则燃烧消耗的氧气相同;
B.醇、醛和羧酸中碳原子数越大,在水中的溶解性越小;
C.加热蛋白质发生变性;
D.某烯烃(最简式为CH2),则含有一个双键,结合2,3-二甲基丁烷的结构简式分析.
解答 解:A.乙酸、葡萄糖的简式为CH2O,淀粉的最简式为C6H10O5,最简式不同,所以燃烧消耗的氧气不相同,故A错误;
B.醇、醛和羧酸中碳原子数越大,在水中的溶解性越小,所以分子量很大的醇、醛和羧酸在水中的溶解度较小,烃与酯的密度都小于1g/cm3,故B错误;
C.加热蛋白质发生变性,蛋白质没有发生水解,所以没有氨基酸生成,故C错误;
D.某烯烃(最简式为CH2),则含有一个双键,2,3-二甲基丁烷由某烯烃加成得到,则该烯烃的结构简式可能为:CH2=C(CH3)CH(CH3)2,(CH3)2C=C(CH3)2,则该烯烃可能有2种结构,故D正确.
故选D.
点评 本题考查了有机物燃烧规律、有机物的溶解性、蛋白质的性质、同分异构体等,题目难度不大,注意把握有机物结构与性质的关系.

练习册系列答案
相关题目
5.用氯气制取并获得碘单质,不能实现实验目的装置是( )
| A. | 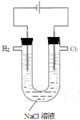 用甲制取少量氯气 | B. | 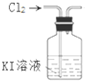 用乙氧化溶液中的碘离子 | ||
| C. | 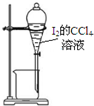 用丙提取置换出来的碘 | D. | 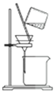 用丁过滤I2的CCl4溶液得碘单质 |
6.下列装置中能将电能转化为化学能的是( )
| A. |  | B. |  | C. | 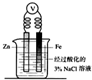 | D. | 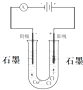 |
3.下列有关物质应用的说法正确的是( )
| A. | 玻璃容器可长期盛放各种酸 | B. | P2O5可用于干燥Cl2和NH3 | ||
| C. | Si和SiO2都用于制造光导纤维 | D. | Na2S可除去污水中的Cu2+ |
10.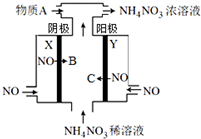 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )| A. | 在阴极NO转化为B,B为硝酸根离子 | |
| B. | 电解一段时间,阴极附近pH升高 | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的A为硝酸 | |
| D. | 该电解池的阳极反应式为:NO-3e-+4OH-=NO${\;}_{3}^{-}$+2H2O |
20.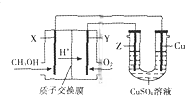 用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )
用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )
 用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )
用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )| A. | Y为燃料电池的正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| B. | 此电解过程中,Z电极上的反应始终为:2H2O-4e-═4H++O2↑ | |
| C. | 电解过程中中铜电极不会被溶解,其原理为牺牲阳极的阴极保护法 | |
| D. | 电子沿着X→Cu→Z→Y路径移动,每个电极均通过0.6mole- |
7.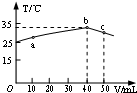 25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )
 25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )| A. | b点时酸碱恰好完全反应 | |
| B. | a→b的过程中,混合溶液中可能存在:c(A)=c(Na+) | |
| C. | HA溶液的物质的量浓度为0.01mol•L-1 | |
| D. | 25℃时,HA的电离平衡常数K约为1.43×10-3 |
4.下列关于有机物莽草酸(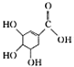 )和鞣酸(
)和鞣酸(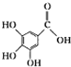 )的叙述中,正确的是( )
)的叙述中,正确的是( )
 )和鞣酸(
)和鞣酸( )的叙述中,正确的是( )
)的叙述中,正确的是( )| A. | 两种有机物中含有完全相同的官能团 | |
| B. | 两种酸都能与溴水反应,且反应类型相同 | |
| C. | 分别向两种酸中滴加三氯化铁溶液,均发生显色反应 | |
| D. | 等物质的量的两种酸与NaOH反应,消耗NaOH的量不同 |
3.下列微粒之间能形成离子键的是( )
①K+
②质量数为19,中子数为10的原子
③第三周期半径最大的原子(Ar除外)
④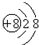
①K+
②质量数为19,中子数为10的原子
③第三周期半径最大的原子(Ar除外)
④
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |