题目内容
5.用氯气制取并获得碘单质,不能实现实验目的装置是( )| A. | 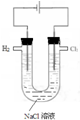 用甲制取少量氯气 | B. | 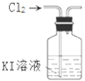 用乙氧化溶液中的碘离子 | ||
| C. | 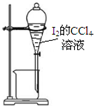 用丙提取置换出来的碘 | D. | 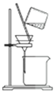 用丁过滤I2的CCl4溶液得碘单质 |
分析 A.电解饱和食盐水,阳极上氯离子失去电子;
B.氯气与KI反应生成碘;
C.碘易溶于四氯化碳;
D.碘与四氯化碳不分层,互溶.
解答 解:A.电解饱和食盐水,阳极上氯离子失去电子,则在阳极上生成氯气,故A正确;
B.氯气与KI反应生成碘,Cl元素的化合价降低,氯气为氧化剂,可知氧化溶液中的碘离子,故B正确;
C.碘易溶于四氯化碳,则图中萃取装置及仪器合理,故C正确;
D.碘与四氯化碳不分层,互溶,不能过滤分离,应选蒸馏法,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、氧化还原反应、电解原理等,把握物离子检验、胶体制备及有机物等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
13.下列关于反应速率的说法正确的是( )
| A. | 同一反应中,各个物质的反应速率相同 | |
| B. | 反应速率只与物质的量有关 | |
| C. | 同一反应中,各个物质的反应速率可能相同 | |
| D. | 反应速率的符号是Vm |
16.下列说法正确的是( )
| A. | 在101kPa下,1g物质完全燃烧所放出的热量叫该物质的热值,单位为kJ•mol-1 | |
| B. | 某放热反应在其它条件不变时,加入催化剂后反应速率加快,同时会放出更多的热量 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H1;C5H12(g)+8O2(g)═5CO2(g)+6H2O(l)△H2.反应热△H1>△H2 | |
| D. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
13.海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
盐卤$\stackrel{Cl_{2}}{→}$低浓度Br2$\stackrel{Na_{2}CO_{3}}{→}$溶液Ⅰ$\stackrel{H_{2}SO_{4}}{→}$Br2
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2↑
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
①步骤②中需控制pH=9.8,其目的是除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去.
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
盐卤$\stackrel{Cl_{2}}{→}$低浓度Br2$\stackrel{Na_{2}CO_{3}}{→}$溶液Ⅰ$\stackrel{H_{2}SO_{4}}{→}$Br2
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2↑
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
20.为实现下列实验目的,所用试剂合理的是( )
| 选项 | 实验目的 | 试剂 |
| A | 除去Fe2O3中的Al2O3 | 稀盐酸 |
| B | 验证Br2的氧化性强于I2 | 溴水、KI溶液、淀粉溶液 |
| C | 检验溴乙烷中含有溴元素 | 溴乙烷、NaOH溶液、AgNO3溶液 |
| D | 制备Fe(OH)3胶体 | 饱和FeCl3溶液、NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
10.下列各组元素性质或原子结构的递变,叙述不正确的是( )
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | Li、Na、K的电子层数依次增多 | |
| D. | N、O、F得电子能力依次减弱 |
17.下列与实验有关的叙述不正确的是( )
| A. | 液溴保存时应加少量水并盛放在用玻璃塞塞紧的试剂瓶中 | |
| B. | 某气体通入品红溶液褪色,加热溶液又变红,该气体为SO2 | |
| C. | 配制硫酸亚铁溶液,可将绿矾晶体溶于蒸馏水并加入一定量的稀硫酸和铁屑 | |
| D. | 某溶液中加盐酸产生使澄清石灰水变浑浊的无色气体,则该溶液一定含CO32- |
14.比较下列各组物质的沸点,正确的是( )
| A. | 乙醇>丙烷 | B. | 甲烷>戊烷 | C. | 1-丁烯>1-庚烯 | D. | 乙二醇>丙三醇 |
15.下列说法正确的是( )
| A. | 等质量的乙酸、葡萄糖与淀粉完全燃烧时消耗氧气的质量相等 | |
| B. | 醇、醛和羧酸都溶于水,烃与酯的密度都小于1g/cm3 | |
| C. | 豆浆中富含大豆蛋白,煮沸后蛋白质水解成了氨基酸 | |
| D. | 某烯烃(最简式为CH2)与H2加成产物为2,3-二甲基丁烷,则该烯烃可能有2种结构 |