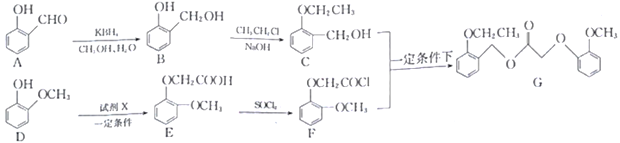
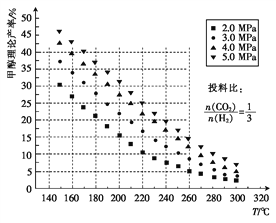
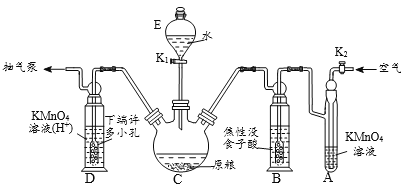
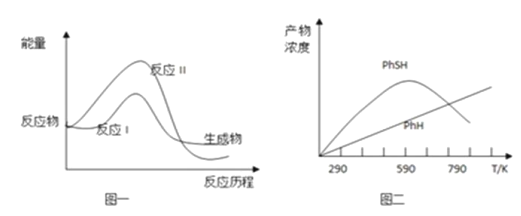
题目内容
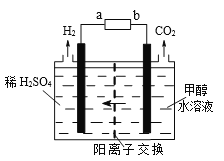
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
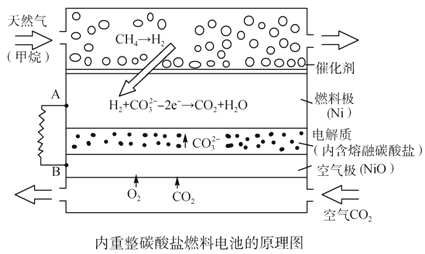
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
【答案】D
【解析】试题分析:A、电解精炼铜,阳极上铜和比铜活泼的金属失电子变为金属阳离子进入电解质溶液,当有0.1 mol e-转移时,若只有铜放电,则有3.2 g铜溶解,粗铜有比铜更活泼的金属首先放电,所以溶解的铜小于3.2g,错误;B、根据图示信息,通入甲烷的电极是负极,在负极上,甲烷变为氢气,氢气发生失电子的氧化反应,即H2-2e-+CO32-==CO2+H2O,错误;C、该电池的电极反应为负极:H2-2e-+CO32-==CO2+H2O,正极:O2+4e-+2CO2==2CO32-,所以碳酸根离子的浓度不变,该电池使用过程中不需补充Li2CO3和K2CO3,错误;D、通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2==2CO32-,正确。

【题目】已知 Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) 在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式 K= ,△H 0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1300℃时加入 Fe、Fe2O3、CO、CO2各1mol , 反应经过10min 后达到平衡.求该时间范围内反应的平均反应速率 v(CO2)= ,CO 的平衡转化率为 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 ______。
A.增加Fe2O3的量
B.加入合适的催化剂
C.移出部分CO2
D.提高反应温度.