题目内容
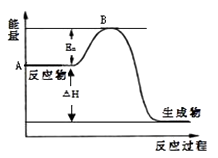
【题目】固定利用CO2对减少温室气体排放意义重大。CO2加氢合成甲醇是CO2综合利用的一条新途径。CO2和H2在催化剂作用下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
(1)测得甲醇的理论产率与反应温度、压强的关系如图所示。
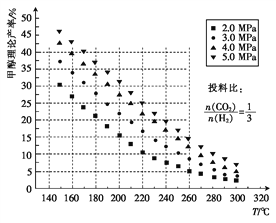
①下列措施能使CO2的转化率提高的是____(填序号)。
A.增大压强 B.升高温度 C.增大H2投料比 D.用更高效的催化剂
②在220℃、5.0MPa时,CO2、H2的转化率之比为___________。
③将温度从220℃降低至160℃,压强从5.0MPa减小至3.0MPa,化学反应速率将_____(填“增大”“减小”或“不变”下同),CO2的转化率将_____。
④200℃时,将0.100 mol CO2和0.275 mol H2充入1 L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,,则此温度下该反应的平衡常数表达式K=_____________(只用数字填,不必计算出结果)。
(2)若H2(g)和CH3OH(l)的燃烧热分别为-285.8kJ·mol﹣1和-726.5kJ·mol﹣1,则由CO2和H2生成液态甲醇和液态水的热化学方程式为________________________________。
(3)甲醇电解法制氢气比电解水法制氢气的氢的利用率更高、电解电压更低。电解装置如图。
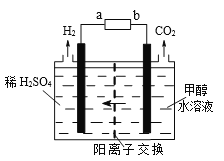
电源的正极为_____(填序号a或b)。其中阳极的电极反应式为_________________;标况下,每消耗1mol甲醇则生成H2的体积为____。
【答案】 AC 1∶1 减小 增大 ![]() CO2(g)+3H2(g)
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H= -130.9kJ·mol-1 b CH3OH+H2O-6e-=CO2+6H+ 67.2L
CH3OH(l)+H2O(l) △H= -130.9kJ·mol-1 b CH3OH+H2O-6e-=CO2+6H+ 67.2L
【解析】(1)①A.正向是气体体积减小的反应,加压平衡正向移动,CO2的转化率提高,故A正确;B.该反应为放热反应,升温有利于平衡逆向移动,CO2的转化率降低,故B错误;C.增大H2投料比有利于平衡正向移动,CO2的转化率提高,故C正确;D.使用催化剂平衡不移动,故D错误;答案为AC。②根据图可知甲醇的理论产率为25%,CO2和H2的投料比为1:3,与反应的系数比一致,所以,CO2、H2的转化率之比相等为1:1。③温度越低、压强越小,反应速率越小,观察图中的数据可知,在140℃,2MPa时,甲醇的产率高于25%,所以二氧化碳的转化率高于25%,即二氧碳的转化率增大。④利用三段式计算:
CO2+3H2CH3OH+H2O
起始(mol/L)0.10.27500
转化(mol/L)0.0250.0750.0250.025
平衡(mol/L)0.0750.20.0250.025
所以![]()
(2)由H2(g)的燃烧热△H为-285.8kJmol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即①H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;②CH3OH(l)+
O2(g)=H2O(l)△H=-285.8kJmol-1;②CH3OH(l)+![]() O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJmol-1,由盖斯定律可知,3×①-②得CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9kJmol-1,故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9kJmol-1;
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJmol-1,由盖斯定律可知,3×①-②得CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9kJmol-1,故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9kJmol-1;
(3)根据产生图示左边应该是溶液中的氢离子得电子生成氢气,得出左边为阴极右边为阳极,故电源a为负极,b为正极;阳极上发生甲醇失电子变成二氧化碳的反应,结合酸性电解质,故阳极电极反应为CH3OH+H2O-6e-=CO2+6H+;每消耗1mol甲醇转移6mol电子,可以生成3mol氢气,故生成的氢气为3mol,体积为67.2L。

 阅读快车系列答案
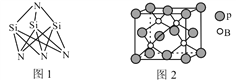
阅读快车系列答案【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示。
X | Y | ||
Q | Z |
这4种元素的原子最外层电子数之和为22。据此回答下列问题:
(1)Q的单质常用于制作半导体,则Q在元素周期表中的位置为________。
(2)X的最低价氢化物的结构式为__________。
(3)Q、X、Z的最高价含氧酸中,酸性最强的是____________。
(4)X、Y和氢3种元素形成的化合物中既含有离子键又含有共价键的是________(任写一种的化学式)。
(5)X的简单氢化物与Y的单质在催化加热条件下反应生成两种氧化物,该反应的化学方程式为_______。