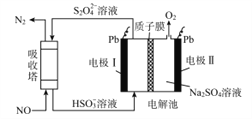
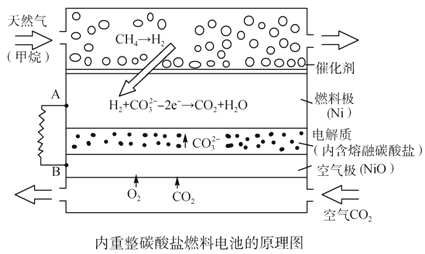
题目内容
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
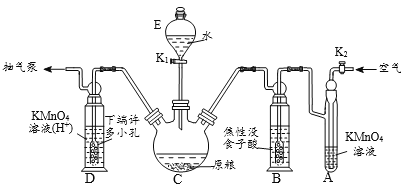
【操作流程】安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
【实验装置】C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应有化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1,该原粮质量________(填“合格”或“不合格”)。
【答案】 三颈烧瓶 使原粮中磷化物与水充分反应 Ca3P2+6H2O===3Ca(OH)2+2PH3↑ 关闭K1、打开K2用抽气泵缓慢抽气,若观察到A、B、D各装置中有气泡产生则气密性良好 [或在D左边用橡胶管和止水夹封闭、关闭K2用压差法;或关闭分液漏斗旋塞后对C加热法] 氧化装置C中生成的PH3 吹出PH3,使其全部被酸性KMnO4溶液吸收 5PH3+8MnO4-+24H+==5H3PO4+8Mn2++12H2O 0.0085 合格
【解析】(1)仪器C的名称是三颈烧瓶;原粮打成粉末可以增大接触面积,有利于反应充分进行;
(2)依据题干信息磷化钙与水反应生成氢氧化钙和磷化氢;利用装置特征关闭K1、打开K2用抽气泵缓慢抽气,若观察到A、B、D各装置中有气泡产生则气密性良好 ;或在D左边用橡胶管和止水夹封闭、关闭K2用压差法;或关闭分液漏斗旋塞后对C加热法; 故答案为:Ca3P2+6H2O===3Ca(OH)2+2PH3↑;关闭K1、打开K2用抽气泵缓慢抽气,若观察到A、B、D各装置中有气泡产生则气密性良好 [或在D左边用橡胶管和止水夹封闭、关闭K2用压差法;或关闭分液漏斗旋塞后对C加热法]
(3)依据装置图中装置中的试剂选择分析判断,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,准确测定PH3的含量,需要用高锰酸钾溶液全部吸收,避免产生较大误差,通入空气的作用是保证PH3全部被吸收的措施。故答案为:氧化装置C中生成的PH3;吹出PH3,使其全部被酸性KMnO4溶液吸收。
(4)PH3被酸性高锰酸钾氧化成磷酸,高锰酸钾被还原为锰离子,结合电子守恒和电荷守恒、原子守恒配平书写得到离子方程式为:5PH3+8MnO4-+24H+==5H3PO4+8Mn2++12H2O
(5)收集E中吸收液,加水稀释至250mL,取25.00mL于锥形瓶中用浓度为5×105mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL;依据滴定反应:2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O;2KMnO45Na2SO3;未反应的高锰酸钾物质的量=![]() ;与PH3反应的高锰酸钾物质的量
;与PH3反应的高锰酸钾物质的量![]() ;根据反应5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;得到定量关系为:5PH38KMnO4;计算得到PH3物质的量
;根据反应5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;得到定量关系为:5PH38KMnO4;计算得到PH3物质的量![]() ;则PH3的质量分数
;则PH3的质量分数![]() ,当粮食中磷化物(以PH3计)的含量不超过0.05mgkg1时,粮食质量合格,所以该原粮质量合格。
,当粮食中磷化物(以PH3计)的含量不超过0.05mgkg1时,粮食质量合格,所以该原粮质量合格。

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示。
X | Y | ||
Q | Z |
这4种元素的原子最外层电子数之和为22。据此回答下列问题:
(1)Q的单质常用于制作半导体,则Q在元素周期表中的位置为________。
(2)X的最低价氢化物的结构式为__________。
(3)Q、X、Z的最高价含氧酸中,酸性最强的是____________。
(4)X、Y和氢3种元素形成的化合物中既含有离子键又含有共价键的是________(任写一种的化学式)。
(5)X的简单氢化物与Y的单质在催化加热条件下反应生成两种氧化物,该反应的化学方程式为_______。
【题目】如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
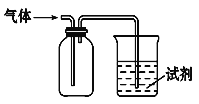
选项 | 试剂 | 现象 | 结论 |
A | 溴水 | 溶液褪色 | SO2有氧化性 |
B | H2S溶液 | 淡黄色沉淀 | SO2有氧化性 |
C | NaOH溶液 | 无明显现象 | SO2与NaOH溶液不反应 |
D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性、没有漂白性 |
A. A B. B C. C D. D