题目内容
【题目】二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量CO2) 直接制备二甲醚,其中的主要过程包括以下四个反应:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ·mol-1
CH3OH(g) ΔH1=-90.1kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH3=+41.1kJ·mol-1
④2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1。试回答下列问题:
CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1。试回答下列问题:
(1)由H2和CO直接制备二甲醚的热化学方程式:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH =_______kJ·mol-1;该反应可以自发进行的条件为________________。
CH3OCH3(g)+H2O(g) ΔH =_______kJ·mol-1;该反应可以自发进行的条件为________________。
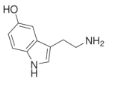
(2)将1.0mol CO2 和 3.0mol H2 充入2L恒容密闭容器中,使其仅按反应②进行,在不同催化剂作用下,相同时间内 CO2 的转化率随温度变化如图所示。下列说法正确的是______________
A.T3对应的平衡常数小于T4对应的平衡常数
B.根据图中曲线分析,催化剂I的催化效果最好
C.b点v(正)可能等于v(逆)
D.a点的转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低
(3)若CO2和H2仅发生反应②和③,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按 n(CO2):n(H2)=1:3(总量为a mol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的 CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
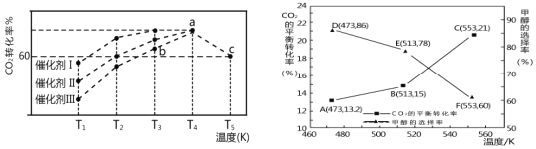
①在553K达到平衡时,反应体系内甲醇的物质的量为_________mol。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:____________________________ 。
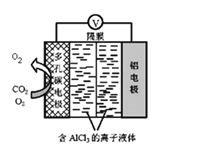
(4)O2催化辅助的 Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。 则电池的正极反应式:6O2+6e-=6O2-和____________________ 。
【答案】-204.7 低温 BD 0.0315a 当温度升高时反应②平衡逆向移动,而反应③平衡正向移动且幅度更大,所以 CO2 的转化率增加,但甲醇的选择性却降低 6CO2+6O2-=3C2O42-+6O2
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式,结合反应特点及反应自发进行的依据判断;
(2)依据外界条件对化学反应速率、化学平衡移动的影响,结合反应特点分析判断;
(3)①按n(CO2):n(H2)=1:3(总量为a mol)投料于恒容密闭容器中进行反应,可得n(CO2),利用CO2在553K时转化率、甲醇的选择率与CO2的乘积就可以计算得此时反应体系内甲醇的物质的量;
②根据温度反应②③的影响分析判断;
(4)根据图示,在多孔电极上,CO2得到电子变为O2、Al2(C2O4)3。
(1)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ·mol-1
CH3OH(g) ΔH1=-90.1kJ·mol-1
④2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1,
CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1,
由于反应热与反应途径无关,只与物质的始态和终态有关,所以①×2+④,整理可得2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH =-204.7kJ·mol-1;该反应的正反应是气体体积减小的放热反应,根据自发进行反应的依据ΔG=ΔH-TΔS<0,ΔH<0,ΔS<0,要使ΔH-TΔS<0,则反应应该在低温下可自发进行;
CH3OCH3(g)+H2O(g) ΔH =-204.7kJ·mol-1;该反应的正反应是气体体积减小的放热反应,根据自发进行反应的依据ΔG=ΔH-TΔS<0,ΔH<0,ΔS<0,要使ΔH-TΔS<0,则反应应该在低温下可自发进行;
(2)将1.0mol CO2 和 3.0mol H2 充入2L恒容密闭容器中,发生反应②:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1,该反应的正反应为气体体积减小的放热反应;
CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1,该反应的正反应为气体体积减小的放热反应;
A.由于该反应的正反应为放热反应,升高温度,化学平衡逆向移动,所以平衡常数:T3>T4,A错误;
B.反应温度低,反应物的转化效率高,则催化剂的催化效果好,根据图示,在相同温度下在催化剂I时CO2转化效率最高,故催化剂I的催化效果最好,B正确;
C.题中说明图中的转化率是在同一时间内测得的,并非平衡的转化率,所以不能判断b点是否平衡,故无法比较v(正)、v(逆)的大小,C错误;
D.根据图示可知:CO2的转化效率在温度比较低的T4高于温度较高的T5,是由于该反应的正反应是放热反应,升高温度,化学平衡逆向移动,导致转化率降,D正确;
故合理选项是BD;
(3)按 n(CO2):n(H2)=1:3(总量为a mol),则其中含有CO2的物质的量n(CO2)=![]() mol=
mol=![]() mol,根据图示可知在553K达到平衡时,反应体系内CO2的平衡转化率为21%,甲醇的选择率为60%,根据C元素守恒,可得甲醇物质的量n(CH3OH)=
mol,根据图示可知在553K达到平衡时,反应体系内CO2的平衡转化率为21%,甲醇的选择率为60%,根据C元素守恒,可得甲醇物质的量n(CH3OH)=![]() mol×21%×60%=0.0315a mol;
mol×21%×60%=0.0315a mol;
②反应③的正反应是吸热反应,升高温度,该反应正向移动,且温度对吸热反应影响更大,使CO2的平衡转化率增加,但对于反应②,由于该反应的正反应是放热反应,升高温度,该反应的化学平衡逆向移动,所以甲醇的平衡转化率反而降低,即甲醇的选择率降低;
(4)该原电池中Al作负极,失电子生成铝离子,电极反应式为Al-3e-=Al3+,正极反应式:6O2+6e-=6O2-、产生的O2-与CO2结合形成草酸根离子,电极反应式为6CO2+6O2-=6O2+3C2O42-,可见O2在反应过程中,在第一个反应中作反应物、在第二个反应中作生成物,所以氧气在反应中作催化剂。