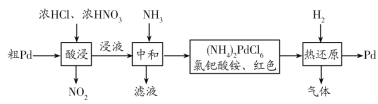
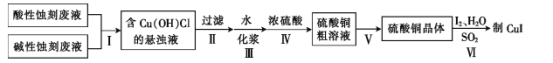
题目内容
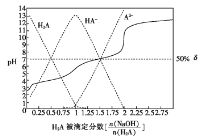
【题目】25 ℃时,用0.1 mol/LNaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数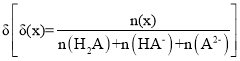 如图所示:
如图所示:
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1NaA溶液中: ![]()
C.0.1 mol·L-1NaHA溶液中: ![]()
D.H2A 的K2=1×10-7
【答案】B
【解析】
由图可知,实线为0.1 mol·L-1NaOH溶液滴定二元弱酸H2A的滴定曲线,虚线为0.1 mol·L-1NaOH溶液滴定二元弱酸H2A的物种分布分数曲线。当![]() =1时,反应生成NaHA,NaHA溶液显酸性,当
=1时,反应生成NaHA,NaHA溶液显酸性,当![]() =2时,反应生成Na2A,Na2A溶液显碱性。
=2时,反应生成Na2A,Na2A溶液显碱性。
A.强碱滴定弱酸时,应选用酚酞做指示剂,则用NaOH溶液滴定0.1 mol·L-1NaHA溶液应用酚酞作指示剂,故A正确;
B. 0.1 mol·L-1Na2A溶液中存在电荷守恒关系c(Na+)+ c(H+)=c(HA-)+2c(A2-)+ c(OH—),因Na2A溶液显碱性,c(OH—) > c(H+),则:c(Na+)>c(HA-)+2c(A2-),故B错误;
C. 由图可知,当![]() =1时,反应生成NaHA,NaHA溶液显酸性,说明HA-的电离大于水解,则溶液中c(Na+)>c(HA-)> c(A2-)> c(H2A),故C正确;
=1时,反应生成NaHA,NaHA溶液显酸性,说明HA-的电离大于水解,则溶液中c(Na+)>c(HA-)> c(A2-)> c(H2A),故C正确;
D. 由图可知,当δ(X)为50%时,溶液中c(HA-)=c(A2-),pH=7,由Ka2=![]() = c(H+)=1×10-7,故D正确;
= c(H+)=1×10-7,故D正确;
故选B。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目