题目内容
2.分子式为C3H4Cl2的链状有机物的同分异构体共有(不包括立体异构)( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
分析 含有两个或两个以上取代基的同分异构体书写,若只凭想象写很容易造成重、漏现象.不如先将所有取代基拿下,分析母体对称性找出被一个取代基取代的产物种类,然后再分析各种一取代物的对称性,看第二个取代基可进入的位置,…,直至全部取代基都代入.
解答 解:(1)先不考虑Cl,写出C3H6的链状同分异构体,只有一种结构:CH3-CH=CH2
(2)由于CH3-CH=CH2 只有三种氢,所以有三种一氯代物:CH2Cl-CH=CH2、CH3-CCl=CH2、CH3-CH=CHCl
(3)再以上述每一种产物为母体,写出二元取代产物:
CH2Cl-CH=CH2 的取代产物有三种:CHCl2-CH=CH2,CH2Cl-CCl=CH2,CH2Cl-CH=CHCl
CH3-CCl=CH2 的取代产物有两种:CH2Cl-CCl=CH2 (重复),CH3-CCl=CHCl
CH3-CH=CHCl 的取代产物有三种:CH2Cl-CH=CHCl (重复),CH3-CCl=CHCl (重复),
CH3-CH=CCl2
所以,分子式为C3H4Cl2链状有机物的同分异构体共有5种.
故选B.
点评 该同分异构体看作是由官能团取代烃中的不同氢而形成的,书写时首先写出有机物的碳链结构,然后利用“等效氢”规律判断可以被取代的氢的种类,一般有几种等效氢就有几种取代位置,就有几种同分异构体.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.有A、B、C、D、E五种短周期元素,A原子核外电子占据5条轨道,有两个未成对电子,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C原子核外有9种不同运动状态的电子,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个.下列说法正确的是( )
| A. | 离子半径:D+>C- | |
| B. | EA2是原子晶体 | |
| C. | A和B形成的原子个数比为1:1的化合物分子是非极性分子 | |
| D. | 以上元素中形成的最高价氧化物对应的水化物酸性最强的是C |
13.下列不能用勒夏特列原理解释的是( )
| A. | 500℃时比室温更有利于合成氨的反应 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
10.在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.2mol•L-1、0.1mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | Y2为0.1 mol•L-1 | B. | X2为0.1 mol•L-1 | ||
| C. | Y2为0.35 mol•L-1 | D. | Z为0.3 mol•L-1 |
14.乙酸乙酯与乙醛(CH3CHO)的混合物中氢元素的质量分数为$\frac{1}{11}$,则氧元素的质量分数为( )
| A. | $\frac{10}{11}$ | B. | $\frac{4}{25}$ | C. | $\frac{4}{11}$ | D. | $\frac{4}{5}$ |
11.漂白粉可由Cl2通入消石灰中制备,漂白粉的有效成分是( )
| A. | Ca(OH)2 | B. | CaCl2 | C. | Ca(ClO)2 | D. | CaCO3 |
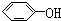
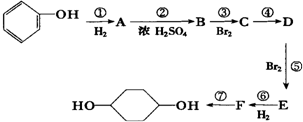 已知实验室由
已知实验室由 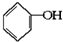 合成
合成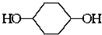 的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)
的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基) 、D
、D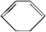
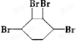
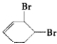 、
、
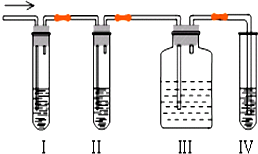 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题: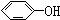 与
与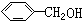
 与
与