题目内容
7.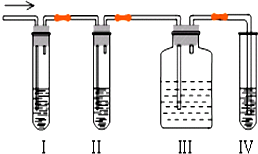 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:(1)I、Ⅱ、Ⅲ、装置可盛放的试剂是IA;ⅡB;Ⅲ品红;IVD(将下列有关试剂的序号填入空格内).
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是Ⅰ中品红溶液褪色.
(3)确定含有乙烯的现象是:Ⅲ中的品红不褪色,Ⅳ中的酸性高锰酸钾溶液褪色.NaOH溶液的作用:吸收二氧化硫,避免对乙烯造成干扰.
(4)写出生成乙烯的反应方程式:C2H5OH$→_{170℃}^{浓硫酸}$C2H4+H2O.
分析 (1)多种产物需检验时,应考虑先后顺序,本题中先检验二氧化硫,然后除去二氧化硫,再检验产物中有乙烯;
(2)根据二氧化硫能漂白品红检验二氧化硫的存在;
(3)装置Ⅲ中确定无二氧化硫,装置Ⅳ中气体与酸性高锰酸钾溶液褪色证明混合气体中含有乙烯,由于二氧化硫也能使酸性高锰酸钾溶液褪色,故检验乙烯前需排除二氧化硫的干扰;
(4)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,据此写出反应的化学方程式.
解答 解:(1)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除尽SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,因装置I用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置II试管装有NaOH溶液除去SO2,装置III试管通过品红溶液不褪色确认SO2已除干净,装置IV 通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:A;B;D;
(2)装置I用来检验SO2,试管中品红溶液褪色,说明含有SO2,故答案为:Ⅰ中品红溶液褪色;
(3)装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,如果Ⅲ中的品红不褪色,Ⅳ中的酸性高锰酸钾溶液褪色,则证明有乙烯生成,二氧化硫也能使酸性高锰酸钾溶液褪色,故检验乙烯前需排除二氧化硫的干扰,二氧化硫为酸性气体,可以用碱液吸收,
故答案为:Ⅲ中的品红不褪色,Ⅳ中的酸性高锰酸钾溶液褪色;吸收二氧化硫,避免对乙烯造成干扰;
(4)乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应的化学方程式为C2H5OH$→_{170℃}^{浓硫酸}$C2H4+H2O,故答案为:C2H5OH$→_{170℃}^{浓硫酸}$C2H4+H2O.
点评 本题主要考查了乙烯的实验室制法以及产物的检验,题目难度中等,注意掌握乙烯的实验室制取原理,明确当有多种产物需检验时,应考虑先后顺序,明确高锰酸钾既能氧化二氧化硫,又能氧化乙烯,是解答本题的关键.

| A. | CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 | |
| B. | 第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 | |
| C. | 第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
| A. | 3,3-二甲基-2-戊烯 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-2-戊烯 | D. | 2,2-二甲基丁烷 |
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
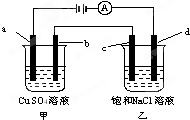
| A. | 甲烧杯中溶液的pH增大,乙烧杯中溶液的pH减小 | |
| B. | 甲烧杯中a电极发生氧化反应,电极反应式为:4OH--4e-═O2↑+2H2O | |
| C. | 电解一段时间后,b极质量增加,c极附近滴加酚酞溶液变红 | |
| D. | C是阳极,电子从d电极通过溶液流向c电极 |
| A. | 1s | B. | 2d | C. | 3p | D. | 4f |

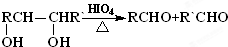

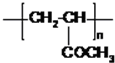 ;
;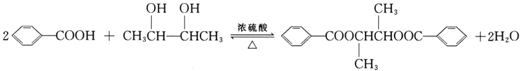 ;
;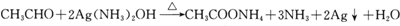 .
.