题目内容
16.目前“低碳经济”正成为科学家研究的主要课题.请回答下列问题:I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:
CH4(g)+H2O(g)?CO(g)+3H2(g)
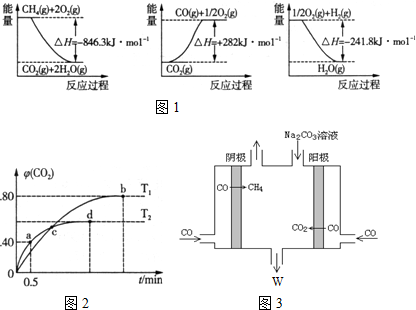
(1)阅读图1,计算该反应的反应热△H=+161.1kJ/mol.
Ⅱ.用CH4或其他有机物、O2为原料可设计燃料电池.
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O═nCO2+4nH+.
(3)以CH4、O2为原料,100mL 0.15mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为n(Na2CO3):n(NaHCO3)=1:1,各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
Ⅲ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),
不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,
测得CO2的体积分数随时间t变化曲线如图2.请回答:
(4)T2时,0~0.5min内的反应速率v(CO)=1.6mol•L-1•min-1.
(5)T1时化学平衡常数K=1024.
(6)下列说法不正确的是B(填字母序号).
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,增大体系压强,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb>Kd
IV.(7)电解CO制备CH4和W,工作原理如图3所示,其原理用电解总离子方程式解释是4CO+3CO32-+5H2O=6HCO3-+CH4↑.
分析 Ⅰ(1)根据能量图书写各自的热化学方程式,再通过盖斯定律计算;
(2)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应;
(3)计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(NaOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断;
Ⅱ(4)根据起始量和a点时CO2的体积分数(即物质量分数),列式计算即可求出从反应开始至a点时的反应速率为v(CO);
(5)根据b点时CO2的体积分数φ(CO2)求出CO和CO2的平衡浓度进而求出T1时化学平衡常数K;
(6)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度是变量,当不变时表明反应达到平衡状态;
B.c点为交点,各气体物质的量分别相等;
C.反应前后气体体积不变,压强变化对平衡无影响;
D.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd
(7)由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体,据此解答即可;
解答 解:Ⅰ(1)由能量图,得①CH4(g)+2O2(g)→CO2(g)+2H2O(g)△H=-846.3kJ•moL-1
②CO2(g)═CO(g)+$\frac{1}{2}$O2(g)△H=+282kJ•moL-1
③$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-241.8kJ•moL-1
①-③×3+②得CH4(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+3H2(g)△H=(-846.3+241.8×3+282)kJ•moL-1=+161.1kJ•moL-1;故答案为:+161.1;
(2)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CnH2nOn-4ne-+nH2O═nCO2+4nH+.
故答案为:CnH2nOn-4ne-+nH2O═nCO2+4nH+;
(3)参与反应的氧气在标准状况下体积为448mL,物质的量为 $\frac{0.448L}{22.4L/mol}$=0.02mol,根据电子转移守恒可知,生成二氧化碳为 $\frac{0.02mol×4}{8}$=0.01mol,n(NaOH)=0.1L×0.15mol•L-1=0.015mol,n(NaOH):n(CO2)=0.015mol:0.01mol=3:2,发生发生2CO2+3NaOH=Na2CO3+NaHCO3+H2O,所以所得溶液中溶质的成分及物质的量之比为n(Na2CO3):n(NaHCO3)=1:1;溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钠离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:n(Na2CO3):n(NaHCO3)=1:1;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
Ⅱ(4)a点时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol x x
a点量/mol 4-x x
根据a点时CO2的体积分数φ(CO2)=$\frac{x}{4}$=0.40,得x=1.6mol
则从反应开始至a点时的反应速率为v(CO)=$\frac{1.6mol}{2L×0.5min}$=1.6mol•L-1•min-1,故答案为:1.6mol•L-1•min-1;
(5)T1时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol y y
b点量/mol 4-y y
根据b点时CO2的体积分数φ(CO2)=$\frac{y}{4}$=0.80,得y=3.2mol,c(CO)=0.4mol•L-1,c(CO2)=1.6mol•L-1
T1时化学平衡常数K=$\frac{c(CO{\;}_{2}){\;}^{5}}{c(CO){\;}^{5}}$=$\frac{1.6{\;}^{5}}{0.4{\;}^{5}}$=1024,
故答案为:1024;
(6)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,所以增大压强平衡不移动,CO的转化率不变,故C正确;
D.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D正确;
故答案为:B;
(7)由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体,据此离子反应方程式为:4CO+3CO32-+5H2O=6HCO3-+CH4↑,故答案为:4CO+3CO32-+5H2O=6HCO3-+CH4↑.
点评 本题考查盖斯定律的应用、化学反应速率和化学平衡常数的相关计算、化学平衡移动原理、电离常数及离子浓度大小的比较等知识,综合性很强,难度很大.

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 10aL | B. | (2a+b)L | C. | (b-a)L | D. | 无法计算 |
| A. | 酸性AgNO3溶液 | B. | HCl溶液 | C. | 稀NaOH溶液 | D. | 酸性CuSO4溶液 |
| A. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 气象环境报告中新增的“PM2.5”是对一种新分子的描述 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 施肥时,草木灰(有效成分为K2CO3)与NH4Cl混合使用效果更好 |
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性, |
| Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)元素Y的氢化物的化学式是:NH3.该氢化物可与该元素的最高价氧化物的水化物生成盐,该盐中的化学键类型是离子键、共价键.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中有一种和其他三种不属于同一类别,该化合物是H2CO3、理由是碳酸是弱酸,其它酸为强酸.
| A. | N2: | B. | NH3 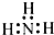 | C. | H2O H+[:O:]2-H+ | D. | NaCl  |
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Z元素的离子半径大于W元素的离子半径 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | Y元素的氧化物是含有极性键的非极性分子 |
| A. | 在元素周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 在元素周期表里,元素所在的周期序数等于原子核外电子层数 | |
| C. | 最外层电子数为8的粒子是稀有气体元素的原子 | |
| D. | 元素的原子序数越大,其原子半径也越大 |