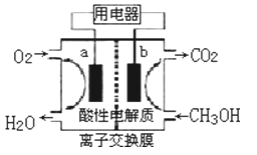
ћвƒњƒЏ»Ё
°Њћвƒњ°њ![]() °Ґ
°Ґ![]() ЇЌ
ЇЌ![]() ‘Џє§“µ…ъ≤ъ÷–”–÷Ў“™µƒ”¶”√°£
‘Џє§“µ…ъ≤ъ÷–”–÷Ў“™µƒ”¶”√°£
£®1£©”√![]() і¶јнЈѕ∆ш÷–µƒ
і¶јнЈѕ∆ш÷–µƒ![]() їб…ъ≥…
їб…ъ≥…![]() °Ґ
°Ґ![]() Ѕљ÷÷µ•÷ °£‘ЏЄ√Јі”¶÷–£ђ—хїѓЉЅ”лїє‘≠ЉЅµƒќп÷ µƒЅњ÷Ѓ±»ќ™_________________________°£
Ѕљ÷÷µ•÷ °£‘ЏЄ√Јі”¶÷–£ђ—хїѓЉЅ”лїє‘≠ЉЅµƒќп÷ µƒЅњ÷Ѓ±»ќ™_________________________°£
£®2£©јы”√![]() њ…ѕы≥э
њ…ѕы≥э![]() ќџ»Њ£ђ∆дЈі”¶ќ™
ќџ»Њ£ђ∆дЈі”¶ќ™![]() £ђ≤їЌђќ¬ґ»ѕ¬£ђѕт„∞”–„гЅњ
£ђ≤їЌђќ¬ґ»ѕ¬£ђѕт„∞”–„гЅњ![]() єћћеµƒ
єћћеµƒ![]() Їг»Ё√№±’»Ё∆ч÷–Ќ®»л
Їг»Ё√№±’»Ё∆ч÷–Ќ®»л![]() £ђ≤вµ√
£ђ≤вµ√![]() ∆шћеµƒћеїэЈ÷ э
∆шћеµƒћеїэЈ÷ э![]() Ћж ±Љд
Ћж ±Љд![]() µƒ±дїѓ«ъѕя»зЌЉЋщ Њ°£
µƒ±дїѓ«ъѕя»зЌЉЋщ Њ°£

Ґўќ¬ґ»ќ™T2 ±£ђ![]() ƒЏ£ђ
ƒЏ£ђ![]() µƒ∆љЊщЈі”¶Ћў¬
µƒ∆љЊщЈі”¶Ћў¬ ![]() _____________________°£
_____________________°£
ҐЏЄ√Јі”¶µƒ![]() ________0£®ћо°∞>°±°∞<°±їт°∞=°±£©£ђ≈–ґѕµƒјн”… «_________________°£
________0£®ћо°∞>°±°∞<°±їт°∞=°±£©£ђ≈–ґѕµƒјн”… «_________________°£
£®3£©≥£ќ¬ѕ¬£ђ“—÷™![]() µƒµзјл∆љЇв≥£ э
µƒµзјл∆љЇв≥£ э![]() £ђ
£ђ![]() £ђЌ®єэЉ∆Ћгњ…µ√
£ђЌ®єэЉ∆Ћгњ…µ√![]() µƒ
µƒ![]() »№“Ї
»№“Ї![]() ___________°£
___________°£
£®4£©ќ™ЅЋ»Јґ®![]() —хїѓЋў¬ Јљ≥ћ љ
—хїѓЋў¬ Јљ≥ћ љ![]() ÷–
÷–![]() µƒ÷µ£®»°’ы э£©£ђљш––ЅЋѕа”¶ µ—й°£µ±»№љв
µƒ÷µ£®»°’ы э£©£ђљш––ЅЋѕа”¶ µ—й°£µ±»№љв![]() µƒ≈®ґ»ќ™
µƒ≈®ґ»ќ™![]() ±£ђ
±£ђ![]() ”лЋў¬ £®
”лЋў¬ £®![]() £© э÷µµƒєЎѕµ»зѕ¬±нЋщ Њ£ђ‘т
£© э÷µµƒєЎѕµ»зѕ¬±нЋщ Њ£ђ‘т![]() _______°£
_______°£
| 3.65 | 7.30 | 10.95 | 14.60 |
| 10.2 | 40.80 | 91.80 | 163.20 |
£®5£©ƒ≥є§“µЈѕЋЃ÷–Їђ”–![]() °Ґ
°Ґ![]() µ»јл„”°£»°“їґ®ЅњµƒЄ√є§“µЈѕЋЃ£ђѕт∆д÷–µќЉ”
µ»јл„”°£»°“їґ®ЅњµƒЄ√є§“µЈѕЋЃ£ђѕт∆д÷–µќЉ”![]() »№“Ї£ђµ±
»№“Ї£ђµ±![]() њ™ Љ≥Ѕµн ±£ђ»№“Ї÷–
њ™ Љ≥Ѕµн ±£ђ»№“Ї÷– _______£®±£ЅфЅљќї”––І э„÷£©°££®“—÷™£Ї25°ж ±£ђ
_______£®±£ЅфЅљќї”––І э„÷£©°££®“—÷™£Ї25°ж ±£ђ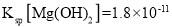 £ђ
£ђ![]() £©
£©
°Њір∞Є°њ1:5 ![]() < ”…ЌЉѕуњ…÷™
< ”…ЌЉѕуњ…÷™![]() £ђ…эЄяќ¬ґ»
£ђ…эЄяќ¬ґ»![]() Љх–°£ђ∆љЇвƒжѕт“∆ґѓ£ђ‘т’эЈі”¶ќ™Ј≈»»Јі”¶£ђ
Љх–°£ђ∆љЇвƒжѕт“∆ґѓ£ђ‘т’эЈі”¶ќ™Ј≈»»Јі”¶£ђ![]() 10 2
10 2 ![]()
°Њљвќц°њ
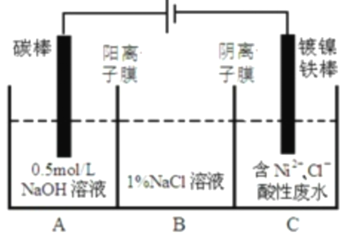
£®1£©Јі”¶÷–ќе—хїѓґюµв„ч—хїѓЉЅ£ђµ√![]() Єцµз„”£ђЅтїѓ«в„чїє‘≠ЉЅ£ђ І»•2Єцµз„”£ђ‘ўјіЈ÷ќцЊЌ»Ё“„ґаЅЋ£ї
Єцµз„”£ђЅтїѓ«в„чїє‘≠ЉЅ£ђ І»•2Єцµз„”£ђ‘ўјіЈ÷ќцЊЌ»Ё“„ґаЅЋ£ї
£®2£©ЄщЊЁЈљ≥ћ љњ…“‘њі≥ц’в «“їЄцЈі”¶«∞Їу∆шћеЈ÷„” эѕаµ»µƒЈі”¶£ђ“тіЋњ…“‘ЄщЊЁ“ї—хїѓћЉµƒ≈®ґ»јііъ±н∆шћеµƒ„№≈®ґ»јіЉ∆Ћг£ї
£®3£©ЄщЊЁ![]() јіЉ∆Ћг£ђ„Ґ“в“™”√
јіЉ∆Ћг£ђ„Ґ“в“™”√![]() јіЉ∆Ћг£ї
јіЉ∆Ћг£ї
£®4£©ЄщЊЁ эЊЁ≤їƒ—њі≥ц£ђµ±≈®ґ»ј©іу2±ґ ±£ђЋў¬ ј©іу4±ґ£ђmµƒ э÷µ„‘»їќ™2£ї
£®5£©Љ»»ї‘ЏЌђ“їЄц»№“Ї÷–£ђ![]() «ѕаЌђµƒ£ђ“тіЋі”ґю’яµƒ
«ѕаЌђµƒ£ђ“тіЋі”ґю’яµƒ![]() ±ніп љјіљш––їѓЉтЉіњ…£ї
±ніп љјіљш––їѓЉтЉіњ…£ї
£®1£©”√![]() і¶јнЈѕЋЃ÷–µƒ
і¶јнЈѕЋЃ÷–µƒ![]() їб…ъ≥…Ѕљ÷÷µ•÷
їб…ъ≥…Ѕљ÷÷µ•÷ ![]() °Ґ
°Ґ![]() £ђ‘тЈҐ…ъЈі”¶µƒїѓ—ІЈљ≥ћ љќ™
£ђ‘тЈҐ…ъЈі”¶µƒїѓ—ІЈљ≥ћ љќ™![]() £ђ—хїѓЉЅќ™
£ђ—хїѓЉЅќ™![]() £ђїє‘≠ЉЅќ™
£ђїє‘≠ЉЅќ™![]() £ђ‘т—хїѓЉЅ°Ґїє‘≠ЉЅµƒќп÷ µƒЅњ÷Ѓ±»ќ™1:5£ї
£ђ‘т—хїѓЉЅ°Ґїє‘≠ЉЅµƒќп÷ µƒЅњ÷Ѓ±»ќ™1:5£ї
£®2£©ҐўЄ√Јі”¶ «∆шћеЈ÷„” э≤ї±дµƒЈі”¶£ђњ™ Љ ±![]() µƒ≈®ґ»ќ™
µƒ≈®ґ»ќ™![]() £ђ„№∆шћеµƒ≈®ґ» Љ÷’≤ї±д°£
£ђ„№∆шћеµƒ≈®ґ» Љ÷’≤ї±д°£![]() ±£ђ
±£ђ![]() µƒ≈®ґ»ќ™
µƒ≈®ґ»ќ™![]() £ђ≤вµ√
£ђ≤вµ√![]() ∆шћеµƒћеїэЈ÷ э
∆шћеµƒћеїэЈ÷ э![]() =30%£ђ“тіЋ
=30%£ђ“тіЋ![]() £ї
£ї
ҐЏ”…ЌЉѕуЈ÷ќц£ђ![]() £ђє
£ђє ![]() £ђ”…
£ђ”…![]() µљ
µљ![]() £ђЉі…эЄяќ¬ґ»£ђ
£ђЉі…эЄяќ¬ґ»£ђ![]() Љх–°£ђЉі…эЄяќ¬ґ»∆љЇвƒжѕт“∆ґѓ£ђє ’эЈі”¶ќ™Ј≈»»Јі”¶£ї
Љх–°£ђЉі…эЄяќ¬ґ»∆љЇвƒжѕт“∆ґѓ£ђє ’эЈі”¶ќ™Ј≈»»Јі”¶£ї
£®3£©ЄщЊЁ“—÷™ћхЉю£ђ![]() £ђ
£ђ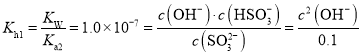 £ђЉ∆Ћгњ…µ√
£ђЉ∆Ћгњ…µ√![]() £ђ
£ђ![]() £ї
£ї
£®4£©єџ≤м±нЄс÷–µƒ эЊЁ£ђ√њµ±![]() ±дќ™2±ґ£ђґ‘”¶µƒЋў¬
±дќ™2±ґ£ђґ‘”¶µƒЋў¬ ![]() „№ «±дќ™4±ґ£ђ“тіЋЄ√Јі”¶Ћў¬ ”л
„№ «±дќ™4±ґ£ђ“тіЋЄ√Јі”¶Ћў¬ ”л![]() µƒ∆љЈљ≥ ’э±»£ђЉіmќ™2£ї
µƒ∆љЈљ≥ ’э±»£ђЉіmќ™2£ї
£®5£©»№“Ї÷–![]() ѕаЌђ£ђ“тіЋЄщЊЁ
ѕаЌђ£ђ“тіЋЄщЊЁ![]() µƒ±ніп љ”–
µƒ±ніп љ”–![]() =
=![]() °£
°£

 ‘ƒґЅњм≥µѕµЅ–ір∞Є
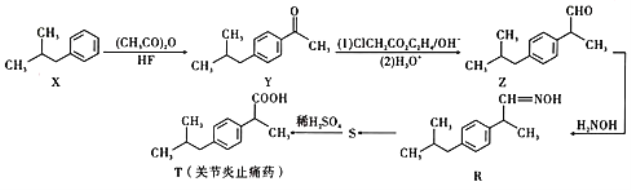
‘ƒґЅњм≥µѕµЅ–ір∞Є°Њћвƒњ°њґю’эґ°їщќэф»Ћбх• «“ї÷÷ЅЉЇ√µƒіу≥¶ЄЋЊъ£ђњЁ≤ЁЄЋЊъµƒ…±ЊъЉЅ°£Їѕ≥…“ї÷÷ґю’эґ°їщќэф»Ћбх•µƒЈљЈ®»зЌЉ1£Ї

љЂ0.45gµƒ2-±љЉ„х£їщ±љЉ„ЋбЇЌ0.500gµƒґю’эґ°їщ—хїѓќэЉ”»лµљ50mL±љ÷–£ђљЅ∞иїЎЅчЈ÷ЋЃ6–° ±°£ЋЃ‘°’ф≥ц»№ЉЅ£ђ≤–ЅфќпЊ≠÷ЎљбЊІµ√µљ∞„…Ђ’л„іЊІће°£
Єчќп÷ µƒ»№љв–‘±н
ќп÷ | ЋЃ | ±љ | ““іЉ |
2-±љЉ„х£їщ±љЉ„Ћб | ƒ—»№ | “„»№ | “„»№ |
ґю’эґ°їщ—хїѓќэ | ƒ—»№ | “„»№ | “„»№ |
’эґ°їщќэф»Ћбх• | ƒ—»№ | “„»№ | “„»№ |
їЎірѕ¬Ѕ–ќ ћв£Ї
£®1£©“«∆чЉ„µƒ„ч”√ «___£ђ∆дљшЋЃњЏќ™___°£
£®2£© µ—й≤ї є”√ѕрљЇ»ыґш є”√ƒ•њЏ≤£ЅІ≤ељ”µƒ‘≠“т «___°£
£®3£©Ј÷ЋЃ∆ч£®““£©÷–Љ”’фЅуЋЃ÷Ѕљ”љь÷Іє№і¶£ђ єјдƒэє№їЎЅчµƒ“Їће÷–µƒЋЃјдƒэљш»лЈ÷ЋЃ∆ч£ђЋЃ√ж…ѕ…э ±њ…ітњ™Ј÷ЋЃ∆чїо»ыЈ≈≥ц£ђ”–їъќп“т√№ґ»–°£ђќї”ЏЋЃ≤г…ѕЈљ£ђі”Ј÷ЋЃ∆ч÷Іє№їЎЅч»л…’∆њ°£±Њ µ—й—°”√µƒЈ÷ЋЃ∆чµƒ„ч”√ «__£®ћо±кЇ≈£©
A£Ѓƒ№”––ІµЎ∞—ЋЃішјлЈі”¶ћеѕµ£ђіўљш∆љЇвѕт’эЈі”¶Јљѕт“∆ґѓ
B£Ѓƒ№Ќ®єэєџ≤мЋЃ√жЄяґ»≤ї‘ў±дїѓµƒѕ÷ѕу£ђ≈–ґѕЈі”¶љб шµƒ ±Љд
C£ЃЈ÷јл”–їъ»№ЉЅЇЌЋЃ
D£Ѓ÷ч“™∆рµљјдƒэ»№ЉЅµƒ„ч”√
£®4£©їЎЅчЇуЈ÷јл≥ц±љµƒЈљЈ® «__°£
£®5£©Ј÷јл≥ц±љЇуµƒ≤–Ѕфќп£ђ“™Њ≠÷ЎљбЊІћбіњ£ђ—°”√µƒћбіњ ‘ЉЅ «__£®ћо±кЇ≈£©
A£ЃЋЃ B£Ѓ““іЉ C£Ѓ±љ
£®6£©÷ЎљбЊІћбіњЇуµƒ÷ Ѕњќ™0.670g£ђЉ∆Ћгґю’эґ°їщќэф»Ћбх•µƒ≤ъ¬ ‘Љќ™__°£
°Њћвƒњ°њЄяіњЅтЋб√ћ„чќ™Їѕ≥…ƒшо№√ћ»э‘™’эЉЂ≤ƒЅѕµƒ‘≠Ѕѕ£ђє§“µ…ѕњ…”…ћм»їґю—хїѓ√ћЈџ”лЅтїѓ√ћњу£®їєЇђFe°ҐAl°ҐMg°ҐZn°ҐNi°ҐSiµ»‘™ЋЎ£©÷∆±Є£ђє§“’»зѕ¬ЌЉЋщ Њ°£їЎірѕ¬Ѕ–ќ ћв£Ї
ѕаєЎљр фјл„”[c0(Mn+)=0.1 mol°§L1]–ќ≥…«в—хїѓќп≥ЅµнµƒpHЈґќІ»зѕ¬£Ї
љр фјл„” | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
њ™ Љ≥ЅµнµƒpH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
≥ЅµнЌк»ЂµƒpH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
£®1£©°∞¬Ћ‘ь1°±Їђ”–SЇЌ__________________________£ї–і≥ц°∞»№љю°±÷–ґю—хїѓ√ћ”лЅтїѓ√ћЈі”¶µƒїѓ—ІЈљ≥ћ љ____________________________________________________°£
£®2£©°∞—хїѓ°±÷–ћнЉ” ЅњµƒMnO2µƒ„ч”√ «љЂ________________________°£
£®3£©°∞µчpH°±≥эћъЇЌ¬Ѕ£ђ»№“ЇµƒpHЈґќІ”¶µчљЏќ™_______~6÷ЃЉд°£
£®4£©°∞≥э‘”1°±µƒƒњµƒ «≥э»•Zn2+ЇЌNi2+£ђ°∞¬Ћ‘ь3°±µƒ÷ч“™≥…Ј÷ «______________°£
£®5£©°∞≥э‘”2°±µƒƒњµƒ «…ъ≥…MgF2≥Ѕµн≥э»•Mg2+°£»ф»№“ЇЋбґ»єэЄя£ђMg2+≥Ѕµн≤їЌк»Ђ£ђ‘≠“т «_____________________________________________________________________°£
£®6£©–і≥ц°∞≥Ѕ√ћ°±µƒјл„”Јљ≥ћ љ___________________________________________________°£
£®7£©≤г„іƒшо№√ћ»э‘™≤ƒЅѕњ…„чќ™пЃјл„”µз≥Ў’эЉЂ≤ƒЅѕ£ђ∆дїѓ—І љќ™LiNixCoyMnz2£ђ∆д÷–Ni°ҐCo°ҐMnµƒїѓЇѕЉџЈ÷±рќ™+2°Ґ+3°Ґ+4°£µ±x=y=![]() ±£ђz=___________°£
±£ђz=___________°£
°Њћвƒњ°њ∞і“™«уїЎірѕ¬Ѕ–ќ ћв£Ї
£®1£©≥£ќ¬ѕ¬£ђљЂµ»≈®ґ»µƒNa2S2O3»№“Ї”лЅтЋб»№“ЇїмЇѕ£ђ2 minЇу»№“Ї÷–√чѕ‘≥цѕ÷їл„«£ђ«л–і≥цѕаєЎЈі”¶µƒјл„”Јљ≥ћ љ£Ї__________________________________________£ї»фљЂіЋїмЇѕ»№“Ї÷√”Џ50°жµƒЋЃ‘°÷–£ђ‘т≥цѕ÷їл„«µƒ ±ЉдљЂ__________ (ћо°∞‘цЉ”°±°Ґ°∞Љх…ў°±їт°∞≤ї±д°±)°£
£®2£©“—÷™![]() µƒµзјл∆љЇв≥£ э
µƒµзјл∆љЇв≥£ э![]() £ђѕт0.1mol/L
£ђѕт0.1mol/L![]() »№“Ї÷–µќЉ”NaOH»№“Ї÷Ѕ
»№“Ї÷–µќЉ”NaOH»№“Ї÷Ѕ![]() 1:18£ђіЋ ±»№“ЇPH=________°£
1:18£ђіЋ ±»№“ЇPH=________°£
£®3£©CO2”лCH4Њ≠іяїѓ÷Ў’ы£ђ÷∆µ√Їѕ≥…∆шCOЇЌH2£Ї
Ґў“—÷™…ѕ цЈі”¶÷–ѕаєЎµƒїѓ—ІЉьЉьƒ№ эЊЁ»зѕ¬£Ї
їѓ—ІЉь | C°™H | C=O | H°™H | C |
Љьƒ№/kJ°§mol1 | 413 | 745 | 436 | 1075 |
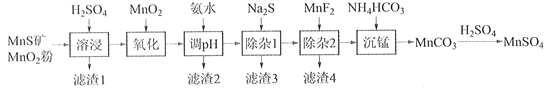
‘тЄ√Јі”¶µƒ»»їѓ—ІЈі”¶Јљ≥ћ љќ™£Ї___________________________°£Ј÷±р‘Џv LЇгќ¬√№±’»Ё∆чA£®Їг»Ё£©°ҐB£®Їг—є£ђ»Ёїэњ…±д£©÷–£ђЉ”»лCH4ЇЌCO2Єч1 molµƒїмЇѕ∆шће°£Ѕљ»Ё∆ч÷–Јі”¶іп∆љЇвЇуЈ≈≥цїтќь ’µƒ»»Ѕњљѕґаµƒ «_______£®ћо°∞A°± їт°∞B °±£©°£
ҐЏ∞і“їґ®ћеїэ±»Љ”»лCH4ЇЌCO2£ђ‘ЏЇг—єѕ¬ЈҐ…ъЈі”¶£ђќ¬ґ»ґ‘COЇЌH2≤ъ¬ µƒ”∞ѕм»зѕ¬ЌЉЋщ Њ°£іЋЈі”¶”≈—°ќ¬ґ»ќ™900°жµƒ‘≠“т «_________________________________°£
£®4£©“—÷™2CH3OH(g) ![]() CH3OCH3(g)£ЂH2O(g)‘Џƒ≥ќ¬ґ»ѕ¬µƒ∆љЇв≥£ эK = 4°£іЋќ¬ґ»ѕ¬£ђ‘Џ√№±’»Ё∆ч÷–Љ”»лCH3OH£ђЈі”¶µљ20min ±≤вµ√Єч„йЈ÷µƒ≈®ґ»»зѕ¬£Ї
CH3OCH3(g)£ЂH2O(g)‘Џƒ≥ќ¬ґ»ѕ¬µƒ∆љЇв≥£ эK = 4°£іЋќ¬ґ»ѕ¬£ђ‘Џ√№±’»Ё∆ч÷–Љ”»лCH3OH£ђЈі”¶µљ20min ±≤вµ√Єч„йЈ÷µƒ≈®ґ»»зѕ¬£Ї
ќп÷ | CH3OH | CH3OCH3 | H2O |
c / mol°§L-1 | 0£Ѓ4 | 0£Ѓ1 | 0£Ѓ1 |
ҐўіЋ ±£ђЈі”¶ѕт___________ (ћо°∞„у°±їт°∞”“°±)“∆ґѓ£ђ≤≈ƒ№іпµљ∆љЇв°£
ҐЏі”Љ”»лCH3OHњ™ ЉЈі”¶µљ20min ±£ђCH3OCH3µƒ…ъ≥…Ћў¬ ќ™_____________°£
Ґџіпµљ∆љЇвЇуCH3OHµƒ≈®ґ»ќ™_____________°£
£®5£©÷∆»°Њџ““ґюЋб““ґюх•µƒЈі”¶Јљ≥ћ љ_______________________________
£®6£©”–“ї÷÷ƒЌ»»–Ќ ч÷ђ≤ƒЅѕ![]() љбєєЉт љќ™
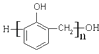
љбєєЉт љќ™![]() ,–і≥ц∆дЇѕ≥…µ•ће≥э±ыѕ©«и£®CH2=CHCN£©,2-Љ„їщ±љ““ѕ©Ќв£ђїє–и“™µƒµ•ће√ы≥∆ «£Ї__________°£
,–і≥ц∆дЇѕ≥…µ•ће≥э±ыѕ©«и£®CH2=CHCN£©,2-Љ„їщ±љ““ѕ©Ќв£ђїє–и“™µƒµ•ће√ы≥∆ «£Ї__________°£
£®7£©”–їъќпR£®C6H12O2£©”лѕ°ЅтЋбє≤»»…ъ≥…AЇЌB£ђAƒ№єїЈҐ…ъ“шЊµЈі”¶£ђB≤їƒ№ЈҐ…ъіяїѓ—хїѓЈі”¶£ђƒ«√іRµƒљбєєЉт љќ™_________°£
£®8£©ќ“єъ—І’яљбЇѕ µ—й”лЉ∆Ћгїъƒ£ƒвљбєы£ђ—–ЊњЅЋ‘ЏљріяїѓЉЅ±н√ж…ѕЋЃ√Ї∆ш±дїї[CO(g)+H2O(g)=CO2(g)+H2(g)]µƒЈі”¶јъ≥ћ£ђ»зЌЉЋщ Њ£ђ∆д÷–ќьЄљ‘ЏљріяїѓЉЅ±н√ж…ѕµƒќп÷÷”√±к„Ґ°£
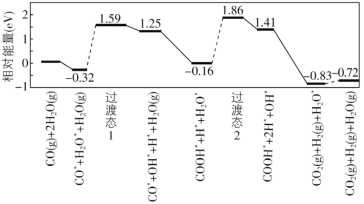
њ…÷™ЋЃ√Ї∆ш±дїїµƒ¶§H________0£®ћо°∞іу”Џ°±°∞µ»”Џ°±їт°∞–°”Џ°±£©£ђЄ√јъ≥ћ÷–„оіуƒ№јЁ£®їоїѓƒ№£©E’э=_________eV£ђ–і≥цЄ√≤љ÷иµƒїѓ—ІЈљ≥ћ љ_______________________°£
£®9£©ƒ≥”–їъќпA”…C°ҐH°ҐO»э÷÷‘™ЋЎ„й≥…,ѕаґ‘Ј÷„”÷ Ѕњќ™90 .љЂ9.0gAЌк»Ђ»Љ…’µƒ≤ъќп“јіќЌ®єэ„гЅњµƒ≈®ЅтЋбЇЌЉо ѓї“,Ј÷±р‘ц÷Ў5.4gЇЌ13.2g£ђAƒ№”лNaHCO3»№“ЇЈі”¶,«“2Ј÷„”A÷ЃЉдЌ—ЋЃњ……ъ≥…∞Ћ‘™їЈїѓЇѕќп.‘тA‘Џ“їґ®ћхЉюѕ¬ЈҐ…ъЋхЊџЈі”¶µƒ≤ъќпµƒљбєєЉт љ «:_________________________
£®10£©“—÷™£Ї (R±н Њћюїщ£ђR1°ҐR2±н Њћюїщїт«в‘≠„”)°£…иЉ∆“‘
(R±н Њћюїщ£ђR1°ҐR2±н Њћюїщїт«в‘≠„”)°£…иЉ∆“‘![]() ќ™‘≠Ѕѕ÷∆±Є
ќ™‘≠Ѕѕ÷∆±Є![]() µƒЇѕ≥…¬Јѕя(ћбє©CH3MgBrЉ∞–и“™µƒќёїъ ‘ЉЅ)_______________________________________________________________°£
µƒЇѕ≥…¬Јѕя(ћбє©CH3MgBrЉ∞–и“™µƒќёїъ ‘ЉЅ)_______________________________________________________________°£