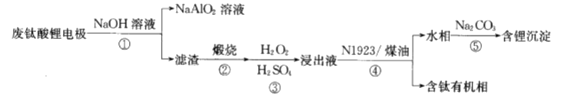
题目内容
【题目】某相对分子质量为40的链状不饱和烃A,能发生如下转化:
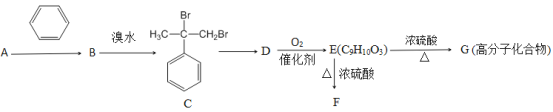
已知:①羟基所连接的碳原子上无氢原子时,难以发生催化氧化;②E能与NaHCO3溶液反应产生气体;③F为酯类化合物。
(1)A的分子式为_____________,A转化为B的反应类型为______________,C转化为D的反应条件为_________________。
(2)B中所含有的官能团的名称为_____________,B中共平面的原子最多有________个。
(3)写出D转化为E的化学方程式:__________________
(4)与E互为同分异构体的芳香族化合物K,已知:①K与E具有相同的官能团;②K不能与FeCl3溶液发生显色反应;③K有二个取代基,则符合上述条件的K共有_________。(填字母代号)
a.3种 b.6种 c. 9种 d.12种
(5)F的结构简式为_________________________。
【答案】C3H4 加成反应 NaOH的水溶液/加热 碳碳双键 17 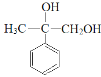 +O2
+O2![]()
 +H2O d
+H2O d 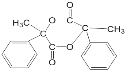
【解析】
由B与溴水反应生成C可知,B与溴水发生的是加成反应,B为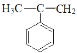 ,已知A为相对分子质量为40的链状不饱和烃,且A与苯反应生成B,A为CH3C
,已知A为相对分子质量为40的链状不饱和烃,且A与苯反应生成B,A为CH3C![]() CH,A转化为B为加成反应,D发生催化氧化生成E,且E能与NaHCO3溶液反应产生气体,则E中含有羧基,则C应发生水解反应生成D,D为
CH,A转化为B为加成反应,D发生催化氧化生成E,且E能与NaHCO3溶液反应产生气体,则E中含有羧基,则C应发生水解反应生成D,D为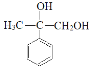 ,D再发生催化氧化生成E,E为
,D再发生催化氧化生成E,E为 ,符合分子式C9H10O3,E发生缩聚反应生成高分子化合物G,
,符合分子式C9H10O3,E发生缩聚反应生成高分子化合物G,
(1)由以上分析可知A为CH3C![]() CH,据此写A的分子式;B为
CH,据此写A的分子式;B为 ,A与苯反应生成B,根据它们的结构的变化判断反应类型;C为卤代烃,D为醇,则C发生水解反应生成D,则反应条件为卤代烃水解的条件;
,A与苯反应生成B,根据它们的结构的变化判断反应类型;C为卤代烃,D为醇,则C发生水解反应生成D,则反应条件为卤代烃水解的条件;
(2)B为 ,则B中所含有的官能团的名称为碳碳双键;根据B中的三种基础结构模型:分别为苯型、乙烯型、甲烷型,分析最多有多少个原子共平面;
,则B中所含有的官能团的名称为碳碳双键;根据B中的三种基础结构模型:分别为苯型、乙烯型、甲烷型,分析最多有多少个原子共平面;
(3)D为 ,E为
,E为 ,则D发生催化氧化生成E,据此写出反应的化学方程式;
,则D发生催化氧化生成E,据此写出反应的化学方程式;
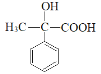
(4)E的分子式C9H10O3,E为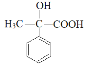 ,与E互为同分异构体的芳香族化合物K,已知:①K与E具有相同的官能团;②K不能与FeCl3溶液发生显色反应;③K有二个取代基,则K中含有苯环,一个醇羟基,一个羧基;
,与E互为同分异构体的芳香族化合物K,已知:①K与E具有相同的官能团;②K不能与FeCl3溶液发生显色反应;③K有二个取代基,则K中含有苯环,一个醇羟基,一个羧基;
(5)E为 ,E可以发生缩聚反应生成高分子化合物G,E转化为F,条件也为浓硫酸加热,且F为酯类化合物,则E转化为F的反应也为酯化反应,则两分子E可以发生酯化反应生成稳定的环状酯。
,E可以发生缩聚反应生成高分子化合物G,E转化为F,条件也为浓硫酸加热,且F为酯类化合物,则E转化为F的反应也为酯化反应,则两分子E可以发生酯化反应生成稳定的环状酯。
由B与溴水反应生成C可知,B与溴水发生的是加成反应,B为 ,已知A为相对分子质量为40的链状不饱和烃,且A与苯反应生成B,A为CH3
,已知A为相对分子质量为40的链状不饱和烃,且A与苯反应生成B,A为CH3![]() CH,A转化为B为加成反应,D发生催化氧化生成E,且E能与NaHCO3溶液反应产生气体,则E中含有羧基,则C应发生水解反应生成D,D为
CH,A转化为B为加成反应,D发生催化氧化生成E,且E能与NaHCO3溶液反应产生气体,则E中含有羧基,则C应发生水解反应生成D,D为 ,D再发生催化氧化生成E,E为
,D再发生催化氧化生成E,E为 ,符合分子式C9H10O3,E发生缩聚反应生成高分子化合物G,
,符合分子式C9H10O3,E发生缩聚反应生成高分子化合物G,
(1)由以上分析可知A为CH3C![]() CH,分子式为C3H4;B为
CH,分子式为C3H4;B为 ,则A转化为B的反应类型为加成反应;C为卤代烃,发生水解反应生成D,D为醇,则C转化为D的反应条件为NaOH的水溶液/加热;
,则A转化为B的反应类型为加成反应;C为卤代烃,发生水解反应生成D,D为醇,则C转化为D的反应条件为NaOH的水溶液/加热;
故答案为:C3H4;加成反应;NaOH的水溶液/加热;
(2)B为 ,则B中所含有的官能团的名称为碳碳双键;B中有三种基础结构模型:分别为苯型、乙烯型、甲烷型,苯型中与苯环直接相连的原子跟苯环共平面,乙烯型中与碳碳双键直接相连的四个原子加两个碳原子共六个原子共平面,甲烷型中最多三个原子共平面,则B中共平面的原子最多有17个;
,则B中所含有的官能团的名称为碳碳双键;B中有三种基础结构模型:分别为苯型、乙烯型、甲烷型,苯型中与苯环直接相连的原子跟苯环共平面,乙烯型中与碳碳双键直接相连的四个原子加两个碳原子共六个原子共平面,甲烷型中最多三个原子共平面,则B中共平面的原子最多有17个;
故答案为:碳碳双键;17;
(3)D为 ,D发生催化氧化生成E,E为
,D发生催化氧化生成E,E为 ,则D转化为E的化学方程式为:
,则D转化为E的化学方程式为: +O2
+O2![]()
 +H2O;
+H2O;
故答案为: +O2
+O2![]()
 +H2O;
+H2O;
(4)E的分子式C9H10O3,E为 ,与E互为同分异构体的芳香族化合物K,已知:①K与E具有相同的官能团;②K不能与FeCl3溶液发生显色反应;③K有二个取代基,则K中含有苯环,一个醇羟基,一个羧基,则符合上述条件的K有以下几种:
,与E互为同分异构体的芳香族化合物K,已知:①K与E具有相同的官能团;②K不能与FeCl3溶液发生显色反应;③K有二个取代基,则K中含有苯环,一个醇羟基,一个羧基,则符合上述条件的K有以下几种:
![]() (邻、间、对三种),
(邻、间、对三种),![]() (邻、间、对三种),
(邻、间、对三种),![]() (邻、间、对三种),
(邻、间、对三种),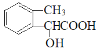 (邻、间、对三种),则共12中,d项正确;
(邻、间、对三种),则共12中,d项正确;
故答案为:d;
(5)E为 ,E可以发生缩聚反应生成高分子化合物G,E转化为F,条件也为浓硫酸加热,且F为酯类化合物,则E转化为F的反应也为酯化反应,则两分子E可以发生酯化反应生成稳定的环状酯,则F的结构简式为
,E可以发生缩聚反应生成高分子化合物G,E转化为F,条件也为浓硫酸加热,且F为酯类化合物,则E转化为F的反应也为酯化反应,则两分子E可以发生酯化反应生成稳定的环状酯,则F的结构简式为 ;
;
故答案为: 。
。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1) 氨气分解反应的热化学方程式如下:2NH3(g) ![]() N2(g)+3H2(g) ΔH
N2(g)+3H2(g) ΔH
若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol1)则上述反应的ΔH=________kJ·mol1。
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,氨气分解反应活化能最大的是________(填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 mol NH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) ![]() N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=________。[已知:气体分压(p分)=气体总压(p总)×体积分数]
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=________。[已知:气体分压(p分)=气体总压(p总)×体积分数]
(3) 关于合成氨工艺的理解,下列正确的是________。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量苇
C.合成氨工业采用10 MPa~30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
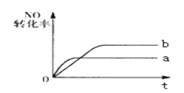
(4) 在1 L 1 mol·L1的盐酸中缓缓通入2 mol氨气,请在图中画出溶液中水电离出的OH浓度随氨气通入变化的趋势图。______________________________
(5) 电化学法也可合成氨。下图是用低温固体质子导体作为电解质,用PtC3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
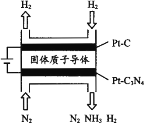
①PtC3N4电极反应产生NH3的电极反应式________。
②实验研究表明,当外加电压超过一定值以后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因________。
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关