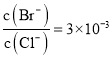题目内容
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式是_______。
(2)根据文献资料,用NaClO3和双氧水在酸性条件下可制得ClO2。某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
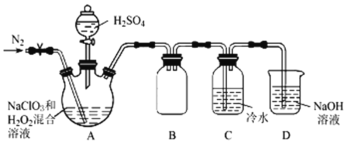
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式是_____。
(3)测定装置C中ClO2溶液的浓度:取10.00 mL C中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入____________作指示剂,用0.1000 mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是________,C中ClO2溶液的浓度是__________mol·L-1。
【答案】2ClO2 + 2CN-=2CO2 + N2 + 2Cl- 稀释二氧化氯,防止二氧化氯的浓度过高而发生爆炸或防倒吸 防止倒吸(或作安全瓶) 2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O 淀粉溶液 当滴入最后一滴标准溶液,溶液蓝色褪去且半分钟内不恢复原色 0.04000 mol/L
根据关系式:2ClO2~5I2~10Na2S2O3,
则n(ClO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1000mol/L×0.02L=0.0004mol,据此计算可得。
×0.1000mol/L×0.02L=0.0004mol,据此计算可得。
【解析】
根据电子得失守恒和质量守恒书写(1)和③的离子方程式和化学方程式,用NaClO3和双氧水在酸性条件下可制得ClO2,装置A发生装置,产生ClO2,装置B是安全瓶作用,装置C收集ClO2,装置D尾气吸收,避免污染环境,测定装置C中ClO2溶液的浓度,应根据2ClO2~5I2~10Na2S2O3关系式,据此计算。
(1)ClO2可将废水中的CN-氧化成CO2和N2,ClO2自身被还原为Cl-,则ClO2中氯元素由+4价得5e-变成Cl-,CN-中碳元素由+2价失2e-变+4价,氮元素由-3价失3e-变0价,由电子得失守恒和质量守恒可写出离子反应式为:2ClO2+2CN-=2CO2+N2+2Cl-;答案为2ClO2+2CN-=2CO2+N2+2Cl-;
(2)①氮气可以搅拌混合液,使其充分反应,还可以稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;答案为稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;
②已知二氧化氯易溶于水,则装置B防止倒吸(或作安全瓶);答案为防止倒吸(或作安全瓶);
③装置A用于生成ClO2气体,NaClO3中氯元素化合价由+5价得e-变成+4价,H2O2中氧元素由-1价失e-变成0价,根据电子得失守恒和质量守恒可写出该反应的化学方程式为2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O;答案为:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O;
(3)根据滴定原理,KI在酸性条件下被ClO2氧化为I2,反应为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O,故选用淀粉溶液做指示剂;用Na2S2O3标准液滴定锥形瓶中的I2,当滴入最后一滴标准液时,锥形瓶内溶液蓝色褪去且半分钟内不恢复原色,说明达到滴定终点;根据2ClO2+10I-+8H+=2Cl-+5I2+4H2O和I2 + 2S2O32-=2I-+ S4O62-可知:2ClO2~5I2~10Na2S2O3,则n(ClO2)= ![]() n(Na2S2O3)=
n(Na2S2O3)= ![]() ×0.1000mol/L×0.02L=0.0004mol,C中ClO2溶液的浓度是c(ClO2)=
×0.1000mol/L×0.02L=0.0004mol,C中ClO2溶液的浓度是c(ClO2)= ![]() =0.04mol/L;答案为淀粉溶液,当滴入最后一滴标准液时,锥形瓶内溶液蓝色褪去且半分钟内不恢复原色,说明达到滴定终点,0.04mol/L。
=0.04mol/L;答案为淀粉溶液,当滴入最后一滴标准液时,锥形瓶内溶液蓝色褪去且半分钟内不恢复原色,说明达到滴定终点,0.04mol/L。

【题目】下列有关叙述不正确的是![]()
选项 | 已知 | 解释与结论 |
A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
B |
该反应在常温下能自发进行 | 该反应的 |
C | 常温下,
| 向 |
D | 向 | 氧化性: |
A.AB.BC.CD.D
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
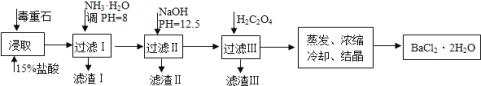
(1)写出“浸取”环节发生的主要离子方程式______。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的______。(双选,填选项字母)
a.烧杯b.容量瓶c.滴定管d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
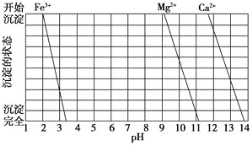
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①滤渣I中含_____(填化学式)。再加入NaOH调节pH=12.5可除去______(填离子符号)
②加入H2C2O4应避免过量的原因是________
(3)25℃,H2C2O4的电离平衡常数如下:
H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
①HC2O4-的电离平衡常数表达式Ka2=__________
②NaHC2O4溶液呈_______(酸性、碱性、中性)