题目内容
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
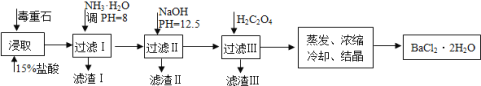
(1)写出“浸取”环节发生的主要离子方程式______。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的______。(双选,填选项字母)
a.烧杯b.容量瓶c.滴定管d.玻璃棒
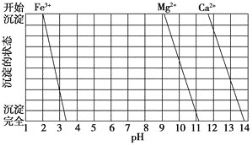
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①滤渣I中含_____(填化学式)。再加入NaOH调节pH=12.5可除去______(填离子符号)
②加入H2C2O4应避免过量的原因是________
(3)25℃,H2C2O4的电离平衡常数如下:
H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
①HC2O4-的电离平衡常数表达式Ka2=__________
②NaHC2O4溶液呈_______(酸性、碱性、中性)
【答案】BaCO3 + 2H+ == Ba2+ + CO2 ↑+ H2O AD Fe(OH)3 Mg2+ 、Ca2+ H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少 Ka2= 酸性
酸性
【解析】
(1)制备BaCl22H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4沉淀,除去Ca2+,蒸发浓缩冷却结晶得到BaCl22H2O,
(2)根据流程图和表中数据分析加入NH3H2O调节pH=8可除去Fe3+,加入NaOH调pH=12.5,可完全除去Mg2+,除去部分Ca2+,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;加入过量H2C2O4,易发生Ba2++H2C2O4═BaC2O4↓+2H+,产品的产量减少;
(3)①HC2O4-溶液中存在电离平衡,结合电离平衡方程式书写电离平衡常数的表达式;
②比较HC2O4-的电离常数和水解常数,判断其溶液的酸碱性。
(1)用15%的盐酸浸取时,毒重石的主要成分BaCO3溶解BaCO3+ 2H+== Ba2++ CO2↑+ H2O。用37%的盐酸配置15%的盐酸,先后使用的仪器有量筒、胶头滴管、烧杯、玻璃棒,故选AD,故答案为:BaCO3+ 2H+== Ba2++ CO2↑ + H2O;AD;
(2)①根据沉淀溶解图,pH在3.3~9.2之间,Fe2+完全沉淀,而Mg2+、Ca2+不会沉淀。用氨水调节pH=8时,滤渣I为Fe(OH)3,同理,再加入NaOH调节pH=12.5时Mg2+完全沉淀,而Ca2+部分沉淀,故答案为:Fe(OH)3;Mg2+、Ca2+;
②加入H2C2O4是为了除去溶液中剩余的Ca2+,因BaC2O4难溶于水,H2C2O4过量会导致生成BaC2O4沉淀,产品产品BaCl22H2O产量减少;故答案为:H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少;
(3) ①HC2O4-的电离方程式为:HC2O4-![]() H++ C2O42-,故表达式为Ka2=
H++ C2O42-,故表达式为Ka2= ;
;
②HC2O4-的电离常数为Ka2=![]() ,HC2O4-的水解常数为Kh2=
,HC2O4-的水解常数为Kh2=![]() =
=![]() ,故HC2O4-以电离为主,NaHC2O4溶液呈酸性,故答案为:酸性。
,故HC2O4-以电离为主,NaHC2O4溶液呈酸性,故答案为:酸性。

【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
(7)写出⑥的单质置换出②的单质的化学方程式:________________________。