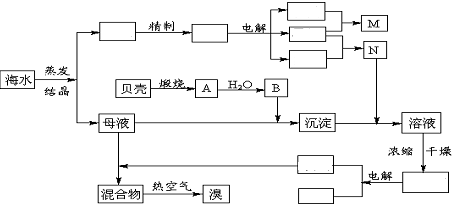
题目内容
14.化学史上很多重要物质的发现背后都有科学家们的兴趣、坚持、创新与传承.例如氨的发现史,阅读下文并填空.1727年,英国牧师、化学家哈尔斯用氯化铵与熟石灰的混合物在以水封闭的曲颈瓶中加热,只见水被吸入瓶中而不见气体放出;
(1)哈尔斯制氨气发生的反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,水吸入曲颈瓶的原理与喷泉实验相同.氨的电子式为
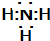 ;
;1774年英国化学家普利斯特里重作这个实验,采用汞代替水来密闭曲颈瓶,即排汞取气法,制得了碱空气(氨).他还研究了氨的性质,他发现
(2)氨可以在纯氧中燃烧,已知该反应为一个置换反应,反应方程式为4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6 H2O,预期该反应在生产上无(填有或无)实际用途.
(3)在氨气中通以电火花时,气体体积在相同条件下增加很多,该反应的化学方程式是2 NH3$\frac{\underline{\;放电\;}}{\;}$N2+3H2,据此证实了氨是氮和氢的化合物.其后戴维等化学家继续研究,进一步证实了氨的组成.
分析 (1)氯化铵与熟石灰反应生成氯化钙、氨气和水,氨气极易溶于水;N原子有1对孤对电子;
(2)置换反应说明有氮气单质生成,氮气是空气的主要成分;
(3)氨气分解生成氮气和氢气.
解答 解:(1)氯化铵与熟石灰反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;氨气极易溶于水可形成喷泉;氨的电子式为 ,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;喷泉;
,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;喷泉;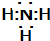 ;
;
(2)置换反应说明有氮气单质生成,氨气与氧气反应生成氮气和水,反应方程式为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6 H2O,氮气是空气的主要成分,该反应无实际用途,故答案为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6 H2O;无;
(3)氨气分解生成氮气和氢气,化学方程式是2 NH3$\frac{\underline{\;放电\;}}{\;}$N2+3H2,故答案为:2 NH3$\frac{\underline{\;放电\;}}{\;}$N2+3H2.
点评 本题考查氮及其化合物的性质,难度不大,侧重于化学方程式的书写.

练习册系列答案
相关题目
4.FeS2与硝酸反应产物有Fe3+和H2SO4,若反应中FeS2和HNO3物质的量之比是1:8时,则HNO3的唯一还原产物是( )
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
5.下列各组中,每种电解质溶液电解时电解水类型的是( )
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | NaOH、H2SO4、Ba(OH)2 | D. | NaBr、H2SO4、Ba(OH)2 |
2.我国在世界上最先应用湿法冶金术冶炼的金属是( )
| A. | Fe | B. | Cu | C. | Ag | D. | Hg |
9.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 锂(Li)的密度比钠小,锂的熔沸点也比钠低 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
3.2014年全国各地都遭遇了“十面埋伏”,二氧化硫、氮氧化物和可吸入颗粒是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化
①已知部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
汽车尾气进化中NO(g)和CO(g)发生反应的热化学方程式为2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-538kJ•mol-1
②若上述反应在绝热、恒荣的密闭体系中进行,并在t1时到达平衡状态,则下列示意图不符合题意的是C(填选项序号)(图中1ω、M、?、z分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO2,再合成硫酸,已知:
2SO${\;}_{{\;}_{2}}$(g)+O2(g)$?_{高温}^{催化剂}$2SO2(g)△H=-196.0kj/mol
①在一定温度的密闭容器中,SO2的转化率时间的变化关系如图2所示,则A点的正反应速率v正(SO2)<B点的正反应速率v正(SO2)(填“大于”、“小于”或“等于”)
②在某温度时,向10L的密闭容器中加入4.0mol SO2和10.0mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同的是BC(填选项序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)用NH3催化还原NO2也可以消除氮氧化物的污染,反应原理为:
NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)
对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cb)也可以表示平衡常数(记作Kp),则上述反应的K的表达式为$\frac{{p}^{3}({H}_{2}O){p}^{2}({N}_{2})}{p(NO)p(N{O}_{2}){p}^{2}(N{H}_{3})}$
(4)以N2O4为原料采用电解法可制备新型绿色硝化剂N2O3,实验装置如图3所示,电解池中生成N2O3的电极反应式为N2O4+2HNO3-e-=2N2O3+O2↑+2H+
(5)尾气中氢氧化物(NO和NO2)可用尿素[CO(NH2)3]溶液除去,反应生成对大气无污染的气体,1mol尿素能吸收工业尾气中氢氧化物(假设NO、NO2体积比为1:1)的质量为76g.
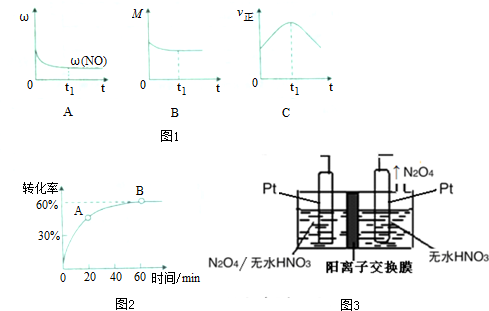
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化
①已知部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
| 化学键 | N=O | C≡O | C=O | N≡N |
| 键能(kj/mol) | 632 | 1072 | 750 | 946 |
②若上述反应在绝热、恒荣的密闭体系中进行,并在t1时到达平衡状态,则下列示意图不符合题意的是C(填选项序号)(图中1ω、M、?、z分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO2,再合成硫酸,已知:
2SO${\;}_{{\;}_{2}}$(g)+O2(g)$?_{高温}^{催化剂}$2SO2(g)△H=-196.0kj/mol
①在一定温度的密闭容器中,SO2的转化率时间的变化关系如图2所示,则A点的正反应速率v正(SO2)<B点的正反应速率v正(SO2)(填“大于”、“小于”或“等于”)
②在某温度时,向10L的密闭容器中加入4.0mol SO2和10.0mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平面浓度和原来平衡浓度相同的是BC(填选项序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)用NH3催化还原NO2也可以消除氮氧化物的污染,反应原理为:
NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)
对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cb)也可以表示平衡常数(记作Kp),则上述反应的K的表达式为$\frac{{p}^{3}({H}_{2}O){p}^{2}({N}_{2})}{p(NO)p(N{O}_{2}){p}^{2}(N{H}_{3})}$
(4)以N2O4为原料采用电解法可制备新型绿色硝化剂N2O3,实验装置如图3所示,电解池中生成N2O3的电极反应式为N2O4+2HNO3-e-=2N2O3+O2↑+2H+
(5)尾气中氢氧化物(NO和NO2)可用尿素[CO(NH2)3]溶液除去,反应生成对大气无污染的气体,1mol尿素能吸收工业尾气中氢氧化物(假设NO、NO2体积比为1:1)的质量为76g.

 元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:
元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题: