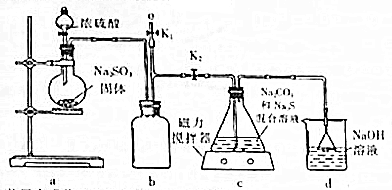
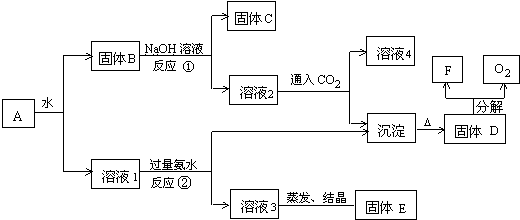
题目内容
5.下列各组物质中全部是弱电解质的是( )| A. | NH3、Cl2、H3PO4 | B. | AgCl、Ba(OH)2、H2S | ||
| C. | H2SO3、NaOH、H2SO4 | D. | NH3•H2O、H2O、CH3COOH |
分析 强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物.即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物.一般是强酸、强碱和大部分盐类.弱电解质是指:在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐;据此即可解答.
解答 解:A、NH3是非电解质,Cl2是单质,既不是电解质也不是非电解质,H3PO4是弱电解质,故A错误;
B、AgCl、Ba(OH)2是强电解质;H2S是弱酸,是弱电解质,故B错误;
C、H2SO3是弱酸,是弱电解质;NaOH、H2SO4是强电解质,故C错误;
D、NH3•H2O是弱碱,是弱电解质;H2O为弱电解质;CH3COOH是弱酸,也是弱电解质,故D正确.
故选D.
点评 本题主要考查了弱电解质的判断,解答须抓住弱电解质的特征“不能完全电离”,平时注意积累常见的弱电解质有助于解题.

练习册系列答案
相关题目
13.下列各组离子在无色溶液中能大量共存,且加入铝粉一定能放出氢气的是( )
| A. | Fe2+、Na+、H+、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ba2+、Na+、OH-、NO3- | D. | Na+、Mg2+、NO3-、OH- |
10.对如图所示装置,叙述正确的是( )
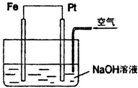

| A. | Fe是正极,Pt是负极 | B. | 该装置中,电子从Fe流向Pt | ||
| C. | 正极反应为:2H++2e-═H2↑ | D. | 负极反应为:4OH--4e-═2H2O+O2↑ |
14.下列各组物质间不能发生反应的是( )
| A. | 铁与稀硝酸 | B. | 铁和硫酸铜溶液 | ||
| C. | 铁和氢氧化钠溶液 | D. | 铁粉与灼热的水蒸气 |
15.下列离子方程式正确的是( )
| A. | 苏打与稀盐酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2 溶液至SO42-刚好完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓ | |
| D. | 向NaClO溶液中通入少量SO2:SO2+ClO-+H2O═SO42-+Cl-+2H+ |