题目内容
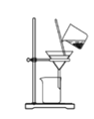
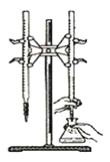
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。提示:图中A代表沉淀或者溶液

(1)检验提纯后的KCl中是否还含有SO42-的方法是____________________________。
(2)用提纯后的KCl配制980 mL 1.00 mol/L的氯化钾溶液,回答下列问题:
①根据计算,所需称量的KCl的质量为__________。
②容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的______。(填数字符号)
③下列操作会使所配溶液浓度偏低的是__________(填选项代号)。
A.配制前容量瓶内壁刻度线以下存有水珠 B.没有洗涤烧杯内壁
C.转移溶液时部分溶液溅出容量瓶外 D.定容时俯视
(3)试剂Ⅰ的名称为______,试剂Ⅱ的化学式为______,试剂Ⅲ的化学式为_____。
【答案】取少量KCl晶体溶于水中,再加入适量稀HCl后,加入适量BaCl2,若有白色沉淀生成,则证明含有SO42-,反之则没有 74.5g ①、③、⑤ BC 氯化钡 K2CO3 HCl
【解析】
据氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量的氯化钡溶液,然后过滤后得到氯化钡、氯化钾的混合溶液A,然后加入过量的碳酸钾溶液,除去氯化钡,过滤得到氯化钾和碳酸钾的混合溶液,再加入过量的盐酸,除去碳酸钾,最后经过加热浓缩,蒸发结晶,除去多余的稀盐酸,得到氯化钾晶体,据此进行分析回答有关的问题。
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量的氯化钡溶液,然后过滤后得到氯化钡、氯化钾的混合溶液A,然后加入过量的碳酸钾溶液,除去氯化钡,过滤得到氯化钾和碳酸钾的混合溶液,再加入过量的盐酸,除去碳酸钾,最后经过加热浓缩,蒸发结晶,除去多余的稀盐酸,得到氯化钾晶体;
(1)检验提纯后的KCl中是否还含有SO42-的方法是取少量KCl晶体溶于水中,再加入适量稀HCl后,加入适量BaCl2,若有白色沉淀生成,则证明含有SO42-,反之则没有;
(2)用提纯后的KCl配制980 mL 1.00 mol/L的氯化钾溶液,则
①实验室无980mL容量瓶,则选择1000mL容量瓶,即配制1000 mL 1.00 mol/L的氯化钾溶液,所需称量的KCl的质量为1L×1.00 mol/L×74.5g/mol=74.5g;
②容量瓶是定容容器,标有温度、容量及刻度线,不标浓度和压强,即选①、③、⑤;
③A.配制前容量瓶内壁刻度线以下存有水珠,不影响溶质和溶液的体积,即对所配溶液浓度无影响,故A错误;
B.没有洗涤烧杯内壁,容量瓶内溶质减少,则所配溶液浓度偏低,故B正确;
C.转移溶液时部分溶液溅出容量瓶外,容量瓶内溶质减少,则所配溶液浓度偏低,故C正确;
D.定容时俯视,溶液的体积偏小,则所配溶液浓度偏高,故D错误;
故答案为BC;
(3)据以上分析可知:试剂Ⅰ的名称为氯化钡,试剂Ⅱ的化学式为K2CO3,试剂Ⅲ的化学式为HCl。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】一定温度下,在三个容积均为1 L的恒容密闭容器中按不同方式投入反应物,发生反应CO(g)+2H2(g)![]() CH3OH(g)(正反应放热),测得反应的相关数据如下:
CH3OH(g)(正反应放热),测得反应的相关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应温度T/K | 500 | 500 | 600 |
反应物投入量 | 1 mol CO、 2 mol H2 | 2 mol CH3OH | 1 mol CO、 2 mol H2 |
平衡v正(H2)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡c(CH3OH)/(mol·L-1) | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(CO) | α2(CH3OH) | α3(CO) |
平衡常数K | K1 | K2 | K3 |
下列叙述正确的是( )
A. v1<v2,2c1>c2B. α1(CO)>α3(CO),v1<v3
C. p2>2p3,K1<K3D. c2>2c3,α2(CH3OH)+α3(CO)<1