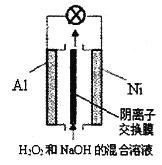
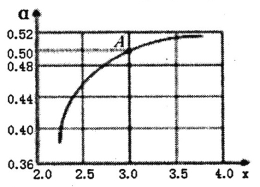
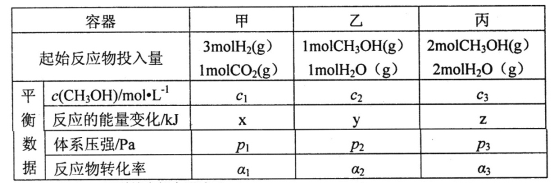
题目内容
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是( )
A. 灼烧海带:
B. 将海带灰溶解后分离出不溶性杂质: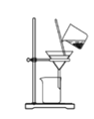
C. 制备Cl2,并将I-氧化为I2:
D. 以淀粉为指示剂,用Na2S2O3标准溶液滴定: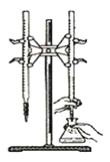
【答案】B
【解析】
A. 灼烧需在坩埚中进行,不能选烧杯,A项错误;
B. 将海带灰溶解后分离出不溶性杂质采用过滤操作,过滤需要玻璃棒引流,图中操作科学规范,B项正确;
C. 制备Cl2,并将I-氧化为I2,除去氯气中的氯化氢应该用饱和食盐水,尾气需用氢氧化钠吸收,C项错误;
D. Na2S2O3为强碱弱酸盐,因S2O32-的水解使溶液呈现碱性,所以滴定时Na2S2O3应该放在碱式滴定管中,而不是酸式滴定管,D项错误;
答案选B。

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目
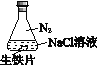
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2