题目内容
【题目】氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为__________,有较强的_________(填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_________。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为_____________________。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
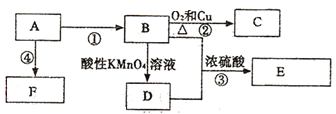
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是__________。该图示的总反应为_______

【答案】+1 氧化 Cl2+2OH—=Cl—+ClO—+H2O 2ClO3—+SO2=ClO2+SO42— 2:5 Cu、H、Cl 2H2S+O2=2S↓+2H2O
【解析】
(1)NaClO中Na元素是+1价,O元素是-2价,结合正负化合价的代数和计算Cl元素的化合价;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(2)①KClO3与SO2在强酸性溶液中反应可制得ClO2,同时应生成硫酸钾;
②可从电子得失守恒的角度计算,也可通过离子方程式计算;
(3)结合图示分析元素化合价的变化,并判断反应物和生成物,再结合守恒法写出总反应方程式。
(1)NaClO中Na元素是+1价,O元素是-2价,有正负化合价的代数和可知Cl元素的化合价为+1价,次氯酸钠具有强氧化性,有杀菌消毒的作用;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O;
(2)①KClO3与SO2在强酸性溶液中反应可制得ClO2,同时应生成硫酸钾,反应的离子方程式为2ClO3-+SO2=2ClO2+SO42-;
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,反应中ClO2为氧化剂,Cl元素化合价由+4价降低为-1价,Mn2+为还原剂,元素化合价由+2价升高到+4价,氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂的物质的量之比为2:5;
(3)据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素;图示反应物为H2S和O2,生成物为S和H2O,Fe2+和Cu2+起催化作用,发生的总反应为2H2S+O2![]() 2S↓+2H2O。
2S↓+2H2O。

 能考试期末冲刺卷系列答案
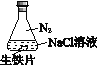
能考试期末冲刺卷系列答案【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2