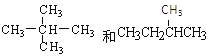��Ŀ����
����Ŀ��(1)�����������γɹ⻯ѧ�����������һ����Ҫԭ����CH4����ԭNOx����һ���̶������������������Ⱦ��
��֪��![]() ��H=��1160kJ��mol-1
��H=��1160kJ��mol-1
![]() ��H=+293kJ��mol-1
��H=+293kJ��mol-1
��������£�CH4����ԭNO2������Ⱦ���Ȼ�ѧ����ʽΪ________________________��
(2)��Ȳ(CH��CH)����Ҫ�Ļ���ԭ�ϡ���ҵ�Ͽ��ü����ѽⷨ��ȡ��Ȳ��![]() ͬʱ��������Ӧ��
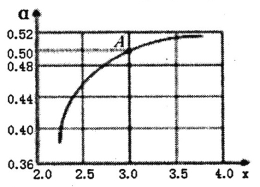
ͬʱ��������Ӧ��![]() ;�����ѽ�ʱ����������ƽ��ʱ��ѹ(Pa)�Ķ�����lgP���¶�(��)֮��Ĺ�ϵ��ͼ��ʾ������ͼ�жϣ���Ӧ
;�����ѽ�ʱ����������ƽ��ʱ��ѹ(Pa)�Ķ�����lgP���¶�(��)֮��Ĺ�ϵ��ͼ��ʾ������ͼ�жϣ���Ӧ![]() ��H___0(����>������<��)��
��H___0(����>������<��)��

1725��ʱ��������ܱ������г���CH4���ﵽƽ��ʱCH4����C2H2��ƽ��ת����Ϊ_____�����¶��£�![]() ��ƽ�ⳣ��Kp=_______[ע����ƽ���ѹ(Pa)����ƽ��Ũ��(mol��L-1)���м���]��
��ƽ�ⳣ��Kp=_______[ע����ƽ���ѹ(Pa)����ƽ��Ũ��(mol��L-1)���м���]��

(3)�������ض��������ò��缫(����Ϊ��˿)��ⱥ�����������Һ�ķ����Ʊ�K2S2O8(���������)���ڵ����µ��Һ����Ҫ����K+��H+��![]() ���ӣ�����ͨ����Һ������Ӧ���������缫��ӦʽΪ______________________________��XΪ_________����Ĥ(����������������������������������)������·��ͨ��0.2mol e-ʱ��������Һ�����ı仯��Ϊ_________��
���ӣ�����ͨ����Һ������Ӧ���������缫��ӦʽΪ______________________________��XΪ_________����Ĥ(����������������������������������)������·��ͨ��0.2mol e-ʱ��������Һ�����ı仯��Ϊ_________��
(4)����ȼ�ϵ�ز��ò�Ϊ�缫�����缫�Ϸֱ�ͨ��CH4��O2���������ҺΪ300mL 1.0mol��L-1��NaOH��Һ����O2ͨ����Ϊ8.96L(��״��)�ҷ�Ӧ��ȫʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ_______________________________��
���𰸡�CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ��H=-867kJmol-1 > 62.5% 102.4Pa 2HSO4-��2e-=S2O82-+2H+ ���� 0.2g c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
N2(g)+CO2(g)+2H2O(g) ��H=-867kJmol-1 > 62.5% 102.4Pa 2HSO4-��2e-=S2O82-+2H+ ���� 0.2g c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
��������
���ݸ�˹���ɷ����Ȼ�ѧ����ʽ����д�ͷ�Ӧ�ȣ�����ƽ���Ӱ�����غ�ƽ�������ʽ����ƽ�ⳣ�������ݵ��ԭ�����������������ĵ缫��Ӧ��������Һ�е����ӵı仯����������Һ�������仯��
��1����![]() ��H=��1160kJ��mol-1����
��H=��1160kJ��mol-1����![]() ��H=+293kJ��mol-1�����ݸ�˹���ɷ�������+�ڵ��Ȼ�ѧ����ʽΪ��CH4(g)+2NO2(g)
��H=+293kJ��mol-1�����ݸ�˹���ɷ�������+�ڵ��Ȼ�ѧ����ʽΪ��CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ��H=��1160+293=-867kJmol-1
N2(g)+CO2(g)+2H2O(g) ��H=��1160+293=-867kJmol-1
��2����ͼ�����������¶����ߣ�����ķ�ѹ(Pa)�Ķ������˵��������٣���˵������ƽ�������ƶ�������H >0�� ��ͼ�������ﵽƽ��ʱ��Ȳ�ķ�ѹΪ100 Pa�������ĵļ���ķ�ѹΪ200Pa����ϩ�ķ�ѹΪ10 Pa�����ĵļ���ķ�ѹΪ20Pa��ʣ�����ķ�ѹΪ100 Pa���������ķ�ѹΪ100+200+20=320 Pa�������������Ȳ��ƽ��ת����Ϊ200/320=62.5%��ƽ��ʱ����ķ�ѹΪ100 Pa����ϩ�ķ�ѹΪ10 Pa���������ķ�ѹΪ300+20=320 Pa��ƽ�ⳣ��Ϊ![]() =102.4Pa��
=102.4Pa��
��3��������������Һ�Ʊ���������أ�����˵����Ԫ�ػ��ϼ����ߣ�������Ϊ����������ʧȥ�������ɹ�����������ӣ��缫��ӦΪ��2HSO4-��2e-=S2O82-+2H+����ҺΪ���ԣ���Ӧ���ɹ���������ӣ�������ӦΪ��2H++2e-=H2������Ϊ���ӽ���Ĥ������0.2mol����ת��ʱ����������������ת��0.2mol�����ӣ���������0.2mol�����ӱ���������������������䣬�������������仯��Ϊ0.2g��
��4����O2ͨ����Ϊ8.96Lʱ����0.4mol������������0.2mol���飬����0.2mol������̼����0.3mol�������Ʒ�Ӧ������0.1mol̼���ƺ�0.1mol̼�����ƣ���Ϊ̼�������ˮ��̶ȱ�̼�������������Һ��̼���������Ũ�ȴ���̼�������Ũ�ȣ���Һ�Լ��ԣ�������Ũ��˳��Ϊ��c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)��

 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д� �ƸԴ��ž�ϵ�д�
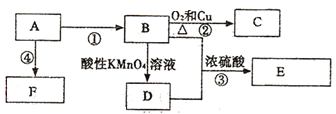
�ƸԴ��ž�ϵ�д�����Ŀ����A��B��C��D���ֽ������±���װ�ý���ʵ�顣
װ�� |
|
|
|
���� | ���۽���A�����ܽ� | C���������� | A����������� |
����ʵ������ش��������⣺
��1��װ�ü��и����ĵ缫��Ӧʽ��______________________________________��
��2��װ�����������ĵ缫��Ӧʽ��_______________________________________��
��3��װ�ñ�����Һ��pH________�����������������С����������������
��4�����ֽ��������ǿ������˳����___________________________________��