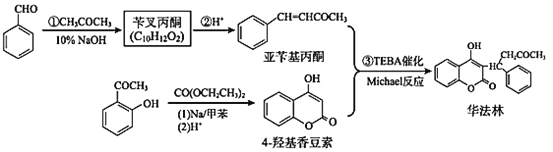
题目内容
【题目】与NO2+互为等电子体的分子________,根据等电子体原理,在NO2+中氮原子轨道杂化类型是________;O22+与N2互为等电子体,1mol O22+中含有的π键数目为________个。
【答案】CO2或CS2 sp 2NA
【解析】
原子总数相同,价电子总数相同的微粒互为等电子体;根据杂化轨道理论确定N原子的轨道杂化类型;等电子体结构相似。
NO2+中含有3个原子、22个价电子,则与NO2+互为等电子体的分子有N2O、CO2、CS2等;NO2+离子的中心原子N原子的价层电子对数=![]() ,所以NO2+中氮原子采取sp杂化;O22+和N2分子为等电子体,其结构和N2结构相似,一个氮气分子中含有2个π键,所以一个O22+中含有2个π键,则1mol O22+中含有的π键数目为2NA,故答案为:N2O或CO2或CS2;sp;2NA。
,所以NO2+中氮原子采取sp杂化;O22+和N2分子为等电子体,其结构和N2结构相似,一个氮气分子中含有2个π键,所以一个O22+中含有2个π键,则1mol O22+中含有的π键数目为2NA,故答案为:N2O或CO2或CS2;sp;2NA。

【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
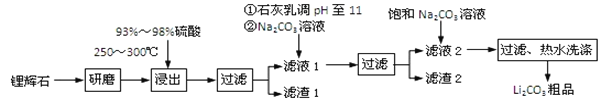
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有 K2Cr2O7 的废水并回收重铬酸,具体的流程如下:
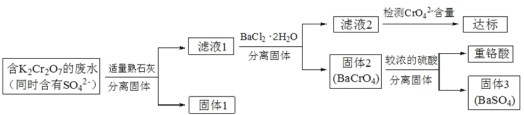
已知:CaCr2O7、BaCr2 O7 易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 | 9.1106 | 2.30 102 | 1.17 1010 | 1.08 1010 |
(1)用离子方程式表示K2Cr2O7溶液中同时存在 K2CrO4的原因(将离子方程式补充完整):______Cr2O72-+______![]() ____CrO42+______
____CrO42+______
(2)向滤液 1 中加入 BaCl2 ![]() 2H2O 的目的是使 CrO42- 从溶液中沉淀出来。
2H2O 的目的是使 CrO42- 从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:_____。
②结合表中数据,说明选用Ba2 不选用Ca2处理废水的理由:_____。
③ 研究温度对CrO42 沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42- 的沉淀率(沉淀率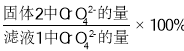 如图所示)
如图所示)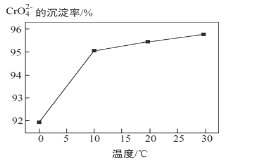
已知:![]()
CrO42- 的沉淀效率随温度变化的原因是_____。
(3)向固体2中加入硫酸,回收重铬酸。
①硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用 0.450 mol/L 的硫酸时,重铬酸的回收率明显高于使用 0.225 mol/L 的硫酸的原因:_____。


②回收重铬酸的原理如上图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_____。
(4)综上所述,沉淀BaCrO4进一步回收重铬酸的效果与_____、_____、有关。