题目内容
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
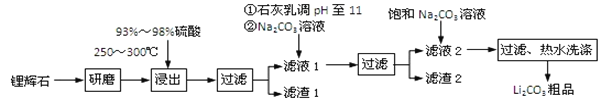
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
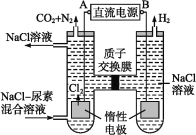
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
【答案】 Al3+ + 3NH3·H2O == Al(OH)3 ↓+ 3NH4+ Ca(OH)2![]() Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀 Li2CO3的溶解度随温度升高而减小 2Cl-—2e-==Cl2 阴极氢离子放电,锂离子向阴极移动 2LiOH+NH4HCO3
Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀 Li2CO3的溶解度随温度升高而减小 2Cl-—2e-==Cl2 阴极氢离子放电,锂离子向阴极移动 2LiOH+NH4HCO3![]() Li2CO3 +2H2O+NH3 ↑ FePO4+Li++ e- = LiFePO4
Li2CO3 +2H2O+NH3 ↑ FePO4+Li++ e- = LiFePO4
【解析】本题考查化学化学工艺流程,(1)根据流程,生成沉淀,需要加入过量试剂a,因为Al(OH)3溶于强碱,不溶于弱碱,因此试剂a为NH3·H2O,发生的离子反应方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(2)石灰乳中存在Ca(OH)2 ![]() Ca2++2OH-,Ca(OH)2属于微溶物,Mg(OH)2属于难溶物,Mg2+结合Ca(OH)2电离产生的OH-生成更难溶的Mg(OH)2,使平衡向右移动,生成氢氧化镁沉淀;(3)根据流程图,制备Li2CO3,根据信息③中溶解度,Li2CO3溶解度随着温度的升高而降低,因此热水洗涤的目的是减少Li2CO3的损失;(4)①根据电解原理,阳极上应是阴离子放电,因此电极反应式为2Cl--2e-=Cl2↑;②根据电解原理,阴极反应式为2H2O+2e-=H2↑+2OH-,阳离子向阴极移动,因此LiOH浓度增大;根据b提供信息,HCO3-与OH-反应生成CO32-和H2O,碳酸锂溶解度较小,因此生成碳酸锂的化学反应方程式为:2LiOH+NH4HCO3
Ca2++2OH-,Ca(OH)2属于微溶物,Mg(OH)2属于难溶物,Mg2+结合Ca(OH)2电离产生的OH-生成更难溶的Mg(OH)2,使平衡向右移动,生成氢氧化镁沉淀;(3)根据流程图,制备Li2CO3,根据信息③中溶解度,Li2CO3溶解度随着温度的升高而降低,因此热水洗涤的目的是减少Li2CO3的损失;(4)①根据电解原理,阳极上应是阴离子放电,因此电极反应式为2Cl--2e-=Cl2↑;②根据电解原理,阴极反应式为2H2O+2e-=H2↑+2OH-,阳离子向阴极移动,因此LiOH浓度增大;根据b提供信息,HCO3-与OH-反应生成CO32-和H2O,碳酸锂溶解度较小,因此生成碳酸锂的化学反应方程式为:2LiOH+NH4HCO3![]() Li2CO3 +2H2O+NH3 ↑;(5)根据原电池的工作原理,正极上发生还原反应,得到电子,因此FePO4在正极上发生反应,即正极反应式为FePO4+Li++e-=LiFePO4。
Li2CO3 +2H2O+NH3 ↑;(5)根据原电池的工作原理,正极上发生还原反应,得到电子,因此FePO4在正极上发生反应,即正极反应式为FePO4+Li++e-=LiFePO4。

 发散思维新课堂系列答案
发散思维新课堂系列答案