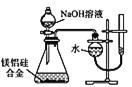
题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
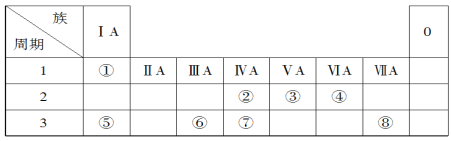
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
除稀有气体外,原子半径最大的元素是______,它的原子结构示意图是________。
(2)②的最高价氧化物的分子式为________;
⑦的最高价氧化物对应水化物的分子式为________;
最高价氧化物对应的水化物中酸性最强的是________。
(3)①④⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:________________________________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是________。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为________________。
【答案】第三周期第ⅣA族 Na ![]() CO2 H2SiO3 HClO4
CO2 H2SiO3 HClO4 ![]() BD b=a+1或b=a+11
BD b=a+1或b=a+11
【解析】
根据元素周期表的结构可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl。
(1)地壳中含量居于第二位的元素是Si,Si位于周期表中第三周期第ⅣA族;除稀有气体外,同一周期在从左到右原子半径减小,从上到下,原子半径增大,因此原子半径最大的元素是钠元素,核电荷数为11,原子结构示意图为:![]() ;
;
故答案为:第三周期第ⅣA族;Na;![]() ;
;
(2)②为C,C的最高价氧化物分子式为CO2, ⑦为Si,Si的最高价氧化物对应的水化物为H2SiO3,⑧为Cl,非金属性最强,其对应的最高价氧化物对应的水化物中酸性最强,为:HClO4;
故答案为:CO2;H2SiO3;HClO4;
(3)①④⑤分别为H、O、 Na,其元素形成的化合物可能是H2O、H2O2、NaOH、Na2O、Na2O2、NaH,其中既含离子键又含共价键的离子化合物是Na2O2和NaOH,其电子式为:![]() ;
;
故答案为:![]() ;
;
(4)W为Se,S、Se为同主族元素,最高正价均为+6价,Se的非金属性比S弱,其最高价氧化物的水化物的酸性,硫酸最强,H2Se的稳定性不及H2S,常温下Se与H2难以化合,选项BD;
故答案为:BD;
(5)若X位于第二、三周期,则b=a+1,若X位于第四周期,则 b=a+11;
故答案为:b=a+1或b=a+11。

 寒假创新型自主学习第三学期寒假衔接系列答案
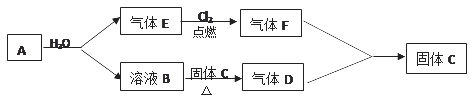
寒假创新型自主学习第三学期寒假衔接系列答案【题目】某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究,其反应原为:3Fe+4H2O(g)![]() Fe3O4+4H2,Fe3O4+8HCl(浓)
Fe3O4+4H2,Fe3O4+8HCl(浓)![]() FeCl2+2FeCl3+4H2O。
FeCl2+2FeCl3+4H2O。
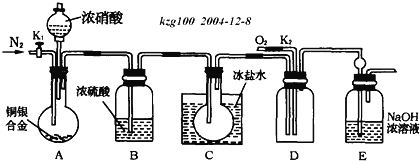
根据如图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。

试回答下列问题:
(1)实验中使用肥皂液检验的产物是___;图中湿棉花的作用是___;
(2)甲组同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:
实验序号 | 实验操作 | 实验现象 |
① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中滴加几滴KSCN溶液,充分振荡 | 溶液没有出现血红色 |
根据上述实验,他们不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是___;
(3)乙组同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4。
实验序号 | 实验操作 | 实验现象 |
① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
请根据乙组同学的实验操作和现象,你认为残留黑色固体中一定___(填“存在”或“不存在”)Fe3O4。