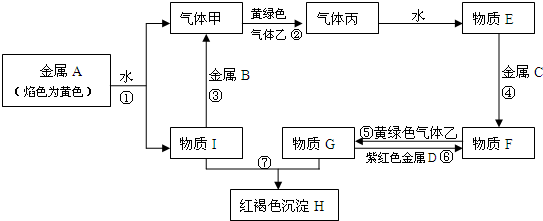
题目内容
20.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了Cu/Zn原电池,该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
分析 (1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,据此写出反应的化学方程式;
故答案为:Zn+CuSO4=ZnSO4+Cu;Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu置换出铜,与锌形成原电池反应,负极锌失去电子生成锌离子,正极氢离子得到电子生成氢气,据此写出电极反应式;
(3)根据影响反应速率的还有浓度、温度、催化剂以及固体表面积大小等因素分析,
(4)①要对比试验效果,除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,则每组硫酸的量要保持相同,六组反应的总体积也应该相同,据此进行分析;
②硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu;Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,负极锌失去电子生成锌离子,电极反应式为:Zn-2e-=Zn2+;正极氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑
故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;
(3)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等,
故答案为:升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等;
(4)①要对比试验效果,除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,则每组硫酸的量需要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30mL,而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10mL,V9=17.5mL,V1=30mL,
故答案为:30;10;17.5;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
点评 本题考查了影响化学反应速率的因素,题目难度中等,明确影响化学反应速率的因素为解答关键,本题的易错点为(4),V1、V6、V9的判断需要根据对照试验要求分析表中数据,最后一问应该能够想到“覆盖”的问题.

 阅读快车系列答案
阅读快车系列答案| A. | 山西王家岭煤矿3•28透水事故被困工作在井下靠吃木屑、树皮,喝凉水维持生命.木屑、树皮的化学成分主要是纤维素 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 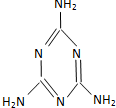 广为人知的奶粉事件中的罪魁祸首为三聚氰胺(结构如图)其摩尔质量为126g | |
| D. | 2010年4月支援青海玉树地震灾区的生活用品中的食醋、纯碱、食盐,其对应的主要化学物质分别属于酸、碱、盐 |
| A. | 氢氧化钠能与盐酸反应,可用作治疗胃酸过多的药剂 | |
| B. | 氧化铝具有很高的熔点,可制耐高温耐火材料 | |
| C. | 常温下,浓硝酸不跟铁发生化学反应,可用铁制容器盛装浓硝酸 | |
| D. | 钠具有极强的还原性,可用钠与CuCl2溶液反应制取铜 |
| A. | 溴乙烷与氢氧化钠的醇溶液共热:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O | |
| B. | 用银氨溶液检验乙醛中的官能团:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| D. | 甘氨酸与氢氧化钠溶液反应:H2N-CH2COOH+OH-→H2N-CH2COO-+H2O |
| A. | H2O | B. | H2CO3 | C. | C6H5OH | D. | CH3CH2OH |

| A. | 该有机物的化学式为C11H12OCl2 | |
| B. | 在同一平面上的碳原子数最多为10个 | |
| C. | 与NaOH醇溶液在加热条件下消去氯原子 | |
| D. | 在铜作催化剂和加热条件下能被O2氧化成醛 |
 和
和
 和
和