题目内容
5.在相同条件下,金属钠与下列物质反应,其中反应速率最慢的是( )| A. | H2O | B. | H2CO3 | C. | C6H5OH | D. | CH3CH2OH |
分析 含有羟基的物质能够与钠反应生成氢气,羟基中O-H键越容易断裂,与钠反应越快,O-H键的强弱受其他原子团的影响.
解答 解:苯酚中的苯基是吸电子基,对O-H共用电子对产生吸引作用,使其极性增强,O-H容易断裂,所以钠与苯酚反应速率快于钠与水的反应;乙醇中CH3CH2-为推电子基,对对O-H共用电子对产生排斥作用,使其极性减弱,O-H更难断裂,所以钠与乙醇反应速率慢于钠与水的反应,碳酸属于酸与钠反应比水快,所以最慢的为乙醇;
故选:D.
点评 本题考查了乙醇、乙酸、苯酚结构和性质,题目难度不大,明确不同原子团对羟基中O-H键的影响是解题关键.

练习册系列答案
相关题目
13.下列物质中,不能使酸性高锰酸钾溶液褪色的是( )
| A. | 乙烯 | B. | 苯 | C. | 乙醛 | D. | 甲酸钠 |
13.工厂用FeCl3溶液腐蚀表面有铜的印刷电路板,课外活动小组为确定生产后废液的组成,进行如下实验:
①取10.0mol废液加入足量的AgNO3溶液,产生沉淀8.61g
②另取10.0mol废液放入足量铜片充分反应,铜片质量减少了0.256g,下列关于原废液组成的判断正确的是( )
①取10.0mol废液加入足量的AgNO3溶液,产生沉淀8.61g
②另取10.0mol废液放入足量铜片充分反应,铜片质量减少了0.256g,下列关于原废液组成的判断正确的是( )
| A. | 只含有Fe2+、Cu2+、Cl- | |
| B. | c(Fe2-):c(Cu2+)=1:2 | |
| C. | c(Cl-)=6.0mol.L-1,c(Fe2+)=1.2mol.L-1 | |
| D. | c(Fe2+):c(Fe3+)=3:1 |
20.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了Cu/Zn原电池,该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了Cu/Zn原电池,该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
10.在下列有色试剂褪色现象中,其褪色原理相同的是( )
| A. | 乙烯能使溴水和酸性KMnO4溶液褪色 | |
| B. | Cl2和SO2均能使品红褪色 | |
| C. | 苯和乙炔都能使溴水褪色 | |
| D. | 甲苯和乙醛均能使酸性KMnO4溶液褪色 |
17.下列推断合理的是( )
| A. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| B. | 向50mL 18mol/L 硫酸中加入足量铜片并加热,被还原硫酸的物质的量是0.45mol | |
| C. | 浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水色后加热也能恢复原色 |
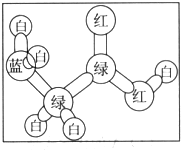 有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题:
有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题: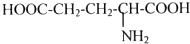 (写结构简式)可以合成二肽
(写结构简式)可以合成二肽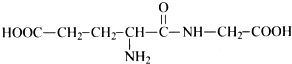
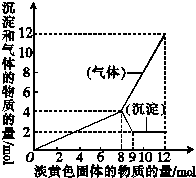 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是Mg2+、Al3+、NH4+,它们的物质的量浓度之比为c(Mg2+):c(Al3+):c(NH4+)=1:1:3,所加淡黄色固体是Na2O2(填化学式).
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是Mg2+、Al3+、NH4+,它们的物质的量浓度之比为c(Mg2+):c(Al3+):c(NH4+)=1:1:3,所加淡黄色固体是Na2O2(填化学式).