题目内容
11.(1)下列实验操作或实验所得出的结论一定正确的是D(填序号)A.加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成
B.把氢氧化钠固体在烧杯中溶解后立即转移到容量瓶中,然后加水定容
C.除去蛋白质中混有的少量NaCl,加入AgNO3溶液后过滤
D.把装有二氧化氮和四氧化氮混合气体的烧瓶浸入到热水中气体颜色加深.
(2)同学们已经学习了同位素、同素异形体、同分异构体这些概念.下面列出了几组物质,请将物质的合适组号填写在下表中.
①
 和
和
②
 和
和
③金刚石与石墨;
④氕、氘与氚;
⑤16O、17O和18O;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑦氧气(O2)与臭氧(O3)
| 类别 | 同位素 | 同素异形体 | 同分异构体 |
| 组号 |
分析 (1)A、根据氯化铵的性质判断;
B、氢氧化钠固体溶解后温度改变;
C、根据蛋白质的性质判断;
D、根据温度对化学平衡的影响判断.
(2)根据同位素、同素异形体、同分异构体的定义判断.
解答 解:(1)A、因为NH4Cl加热时发生反应:NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑,生成NH3的同时还生成酸性的HCl,
假如检验时温度依然较高,那么不但有NH3还有HCl.HCl呈酸性,而NH3的检验是利用其碱性.这样会对检验造成干扰.到达管口以后又冷却下来,那么会发生反应:NH3+HCl=NH4Cl,产生NH4Cl的白烟.白烟溶于试纸上的水后,生成NH4Cl溶液.NH4Cl是强酸弱碱盐,水解呈酸性,因此试纸还是红色,检验不出NH3,故A错误;
B、氢氧化钠固体的溶解是放热的,使溶液温度升高,必须等溶液达室温时才能转移到容量瓶中,否则,对配置的溶液浓度有影响,故B错误;
C、重金属盐能使蛋白质变性,故C错误;
D、二氧化氮转化成四氧化二氮是放热的,升高温度,平衡向逆反应方向移动,所以气体颜色加深,故D正确.故选D;
(2)同位素:质子数相同中子数不同的同一元素的不同原子互称同位素.
同素异形体:由同种元素组成的不同单质.
同分异构体:分子式相同结构不同的化合物互称同分异构体.
根据定义判断,故答案为:
| 类别 | 同位素 | 同素异形体 | 同分异构体 |
| 组号 | ④⑤ | ③⑦ | ②⑥ |
点评 本题主要考查的是常见实验室中氨气的检验、常见物质的除杂以及同分异构体、同位素和同素异形体的判断,难度不大.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 基态原子第五电子层只有2个电子,则该原子第四电子层的电子数肯定为8或18个 | |
| B. | 核外电子数为奇数的基态原子,其原子轨道中一定含有未成对电子 | |
| C. | R为第二周期元素,其原子具有的电子层数为最外层电子数的$\frac{1}{2}$,它可能形成的含氧酸根离子有 ①RO${\;}_{3}^{2-}$、②R2O${\;}_{4}^{2-}$、③RO${\;}_{4}^{2-}$ | |
| D. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be |
20.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了Cu/Zn原电池,该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了Cu/Zn原电池,该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
1.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 1molCH4分子中共价键总数为4NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 标准状况下,5.6LCCl4含有的分子数为0.25NA | |
| D. | 28gN2和1molCH2=CH2所含电子数都是14NA |

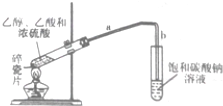 合成乙酸乙酯的路线如下:
合成乙酸乙酯的路线如下: .
.