题目内容
6.工业上合成氨时一般采用500℃左右的温度,其原因是( )(1)适当提高氨的合成速率(2)提高氢气的转化率(3)提高氨的产率(4)催化剂在5000C时活性最大.
| A. | 只有(1) | B. | (1)(2) | C. | (2)(3)(4) | D. | (1)(4) |
分析 N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3 △H<0,该反应是放热的可逆反应,要使平衡向正反应方向移动,应降低温度,但温度过低反应速率过小,不利于工业生成效益;温度越高,反应速率越大,所以应适当升高温度,使反应速率增大;使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度,以此解答.
解答 解:合成氨发生:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3 △H<0,
升高温度可增大反应速率,适当提高氨的合成速率,故(1)正确;
该反应的正反应为放热反应,升高温度不是提高转化率,或氨气的产率故(2)(3)错误;
该温度时,催化剂的活性最大,有利于增大反应速率,提高产量,故(4)正确.
故选D.
点评 本题考查化学平衡知识,侧重于化学与生产的关系的考查,有利于培养学生的良好科学素养和提高学习的积极性,要注意:1、压强只对反应前后气体体积发生变化的可逆反应有影响,2、催化剂只影响反应速率,不影响化学平衡移动,难度不大.

练习册系列答案
相关题目
16.在容积一定的密闭容器中,发生可逆反应:A(g)+B(g)?xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是( )
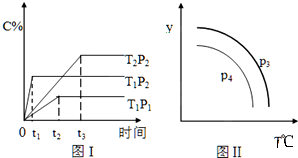

| A. | x=2,T1>T2,P2>P1 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
17.下列式子表示的物质一定是纯净物的是( )
| A. | C3H8O | B. | CH2O | C. | C2H4Cl2 | D. | C4H8O2 |
14.下列排序不正确的是( )
| A. | 晶体熔点的高低: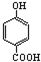 > >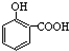 | |
| B. | 原子的价层电子数目的多少:Fe>As>K | |
| C. | 分子中的键角大小:CO2>H2O>NH3 | |
| D. | 微粒半径的大小:O2->F->Na+>Li+ |
1.下列对药品的有关叙述正确的是( )
| A. | 阿司匹林肠溶片具有较强的解热镇痛和抗炎、抗风湿效用,它能防止药物对胃的刺激 | |
| B. | “胃舒平”是抗酸药,主要用于治疗胃酸分泌过多的疾病,长期服用无任何副作用 | |
| C. | 青霉素是一种天然抗生素,对人体细胞的毒性很低,对病毒引起的疾病有良好的疗效 | |
| D. | 药物作用于人体,除了有治疗功效外,还可能引起不良反应,但不会危害人体健康 |
18.将一盛满Cl2的试管倒立在水槽中,当日光照射一段时间后,试管中气体颜色变成淡黄绿色,此时试管中的气体是( )
| A. | 只有O2 | B. | 只有Cl2 | C. | O2、Cl2 | D. | 无法判断 |
15.已知:2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O.向含2mol NaOH,1mol Ba(OH)2,2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
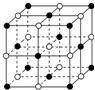 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知: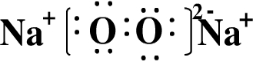 ,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.