题目内容
5.m g 铜与足量浓硫酸完全反应,放出的气体经干燥后为n L,则被还原的硫酸为( )| A. | $\frac{m}{64}$ g | B. | $\frac{48m}{32}$$\frac{49m}{32}$g | C. | $\frac{n}{22.4}$mol | D. | 不能确定 |
分析 铜与浓硫酸反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,浓硫酸的作用有:酸性和强氧化性,反应中1molCu参加反应,由1molH2SO4被还原,以此解答.
解答 解:n(Cu)=$\frac{m}{64}$mol,如为标准状况下,则V(SO2)=$\frac{n}{22.4}$mol,反应的方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
由方程式可知,参加反应的铜的物质的量与生成二氧化硫的物质的量相等,等于被还原的硫酸的物质的量,即被还原的硫酸的物质的量为$\frac{m}{64}$mol,质量为$\frac{49m}{32}$g,由于气体存在的状态不一定为标准状况下,则不能根据气体的体积计算,只有B符合.
故选B.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意根据反应的方程式解答该题,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.以下化石能源的加工所得产品不符合事实的是( )
| A. | 石油分馏-乙炔 | B. | 石油裂解-乙烯 | ||
| C. | 煤焦油分馏-苯酚 | D. | 天然气热分解-炭黑 |
16.在容积一定的密闭容器中,发生可逆反应:A(g)+B(g)?xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是( )
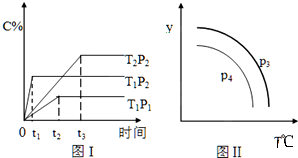

| A. | x=2,T1>T2,P2>P1 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
20.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称为:2-甲基-2-乙基丙烷 的名称为:2-甲基-2-乙基丙烷 | |
| B. | 右图是某有机物分子的比例模型,该物质可能是一种氨基酸 | |
| C. | 能用新制氢氧化铜鉴别甘油、葡萄糖溶液、甲酸钠溶液 | |
| D. | 木糖醇( )和葡萄糖( )和葡萄糖( ),互为同系物,均属于糖类 ),互为同系物,均属于糖类 |
10.如图装置或操作能达到实验目的是( )
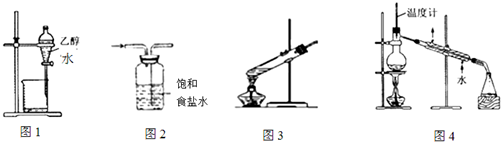

| A. | 图1装置用于分离乙醇和水 | B. | 图2装置用于除去氯气中的氯化氢 | ||
| C. | 图3装置用于葡萄糖的银镜反应 | D. | 图4装置用于石油的蒸馏 |
17.下列式子表示的物质一定是纯净物的是( )
| A. | C3H8O | B. | CH2O | C. | C2H4Cl2 | D. | C4H8O2 |
14.下列排序不正确的是( )
| A. | 晶体熔点的高低: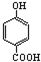 > >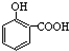 | |
| B. | 原子的价层电子数目的多少:Fe>As>K | |
| C. | 分子中的键角大小:CO2>H2O>NH3 | |
| D. | 微粒半径的大小:O2->F->Na+>Li+ |
15.已知:2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O.向含2mol NaOH,1mol Ba(OH)2,2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
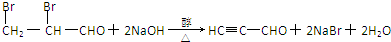 .
.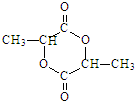 .
.