题目内容
4.有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取0.442g灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成0.200g沉淀,灼烧后的残渣能与30mL盐酸恰好完全反应得到氯化钠溶液.试求:(计算要求有必要的过程,否则不给分)(1)写出碳酸氢钠受热分解的方程式:
(2)求混合物中碳酸钠的质量
(3)所用盐酸的物质的量浓度.
分析 (1)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,根据反应物、生成物及反应条件书写方程式;
(2)灼烧时固体质量减少,减少的质量相当于碳酸质量,将放出的气体通入足量澄清石灰水中,生成沉淀为CaCO3,n(CaCO3)=$\frac{0.200g}{100g/mol}$=0.002mol,根据C原子守恒及方程式计算n(NaHCO3),根据m=nM计算碳酸氢钠质量,从而得到碳酸钠离子;
(3)灼烧时固体质量减少,减少的质量相当于碳酸质量,根据C原子守恒计算碳酸质量,剩余质量相当于灼烧后碳酸钠质量,根据碳酸钠和稀盐酸之间的关系式计算c(HCl).
解答 解:(1)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,根据反应物、生成物及反应条件书写方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,答:碳酸氢钠分解反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)灼烧时固体质量减少,减少的质量相当于碳酸质量,将放出的气体通入足量澄清石灰水中,生成沉淀为CaCO3,n(CaCO3)=$\frac{0.200g}{100g/mol}$=0.002mol,根据C原子守恒及方程式得n(CaCO3)=n(CO2)=$\frac{1}{2}$n(NaHCO3)=0.002mol,则n(NaHCO3)=0.004mol,根据m(NaHCO3)=nM=0.004mol×84g/mol=0.336g,碳酸钠质量=0.442g-0.336g=0.106g,
答:混合物中碳酸钠的质量是0.106g;
(3)灼烧时固体质量减少,减少的质量相当于碳酸质量,根据C原子守恒计算n(CaCO3)=n(CO2)=n(H2CO3)=0.002mol,则灼烧固体减少的质量=0.002mol×62g/mol=0.124g,剩余质量就是灼烧后碳酸钠质量=0.442g-0.124g=0.318g,根据碳酸钠和稀盐酸之间的关系式n(HCl)=2n(Na2CO3)=$\frac{0.318g}{106g/mol}$×2=0.006mol,c(HCl)=$\frac{0.006mol}{0.03L}$=0.2mol/L,
答:盐酸的物质的量浓度为0.2mol/L.
点评 本题考查混合物的有关计算,为高频考点,明确发生的反应及各个物理量之间的关系是解本题关键,注意原子守恒的灵活运用,题目难度不大.

| A. | 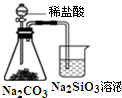 图所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 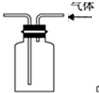 用图所示实验装置排空气法收集CO2气体 | |
| C. | 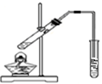 用图装置制备少量乙酸乙酯 | |
| D. | 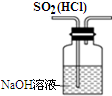 图装置可以用来除去SO2中的HCl |
| A. | 石油分馏-乙炔 | B. | 石油裂解-乙烯 | ||
| C. | 煤焦油分馏-苯酚 | D. | 天然气热分解-炭黑 |
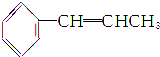 中,处于同一平面内的原子最多有( )
中,处于同一平面内的原子最多有( )| A. | 16个 | B. | 17个 | C. | 18个 | D. | 19个 |
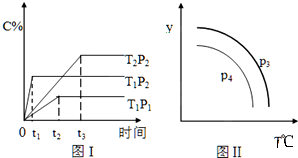
| A. | x=2,T1>T2,P2>P1 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
| A. | 晶体熔点的高低: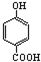 > >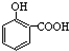 | |
| B. | 原子的价层电子数目的多少:Fe>As>K | |
| C. | 分子中的键角大小:CO2>H2O>NH3 | |
| D. | 微粒半径的大小:O2->F->Na+>Li+ |
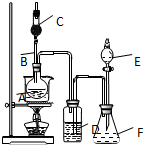 为证明乙醇分子中含有氧原子,运用R-OH+HCl═RCl+H2O反应生成的水(H2O),检测其中的氧.现采用一套如图所示装置进行实验. 装置中所装的试剂:
为证明乙醇分子中含有氧原子,运用R-OH+HCl═RCl+H2O反应生成的水(H2O),检测其中的氧.现采用一套如图所示装置进行实验. 装置中所装的试剂: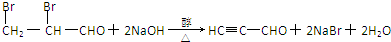 .
. .
.