题目内容
4.下列各图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键.下列各图表示的结构与化学式一定不相符的是( )| A | B | C | D |
 |  |  |  |
| NH3 | C2H2 | CCl4 | CO2 |
| A. | A、 | B. | B | C. | C | D. | D |
分析 A、氨气中氮原子最外层有1对孤对电子;
B、乙烯为平面结构,C与C形成一对共价键;
C、四氯化碳中Cl最外层还有3对孤对电子;
D、二氧化碳中C与O形成2对共价键,据此解答即可.
解答 解:A、氨气中N与H形成三对共价键,剩余一对孤对电子,故A正确;
B、乙烯爱好C与C形成碳碳双键,是平面结构,故B正确;
C、四氯化碳中Cl的最外层三对孤对电子漏掉,故C错误;
D、二氧化碳中C分别与两个O形成2对共价键,O剩余2对孤对电子,故D正确;
故选C.
点评 本题考查了常见元素的成键特点,题目难度不大,注意把握原子形成的共价键数目与其原子核外的单电子数有关.

练习册系列答案
相关题目
14.铝土矿的主要成分为氧化铝,还有少量的氧化铁和二氧化硅杂质.工业上经过下列工艺可以冶炼金属铝:
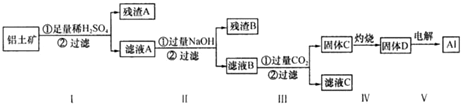
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 滤液A 可用于净水,其净水原理为Al3++3H2O═Al(OH)3+3H+ | |
| B. | 固体C→固体D 的操作过程中主要仪器是酒精灯、蒸发皿、玻璃棒 | |
| C. | 滤液C 中存在以下关系:c(Na+)=c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+) | |
| D. | 若在100 mL 滤液B 中加入1 mol•L-1HCl 200 mL,沉淀达到最大且质量为11.7 g,则滤液B 中c(Na+)大小2 mol•L |
15.在某学生的化学实验报告中有如下记录其中实验数据合理的( )
| A. | 用托盘天平称取11.7 g CuO粉末 | |
| B. | 用100 mL量筒量取5.26 mL稀硫酸溶液 | |
| C. | 温度计上显示的室温读数为25.68℃ | |
| D. | 用广泛pH试纸测得溶液的pH为3.5 |
12.下列说法不正确的是( )
| A. | 碘易升华,应该密封保存 | |
| B. | 液溴应保存在磨口玻璃塞深棕色细口试剂瓶中,并加少量水进行水封 | |
| C. | 酒精与水互溶,所以不能用酒精把碘从碘水中萃取出来 | |
| D. | 用加热的方法可以将NH4Cl与碘的混合物分离 |
9.我国纳米专家王雪发明的“WXP复合纳米材料”主要化学成分是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用.鉴于此,可将此新技术应用到人民币制造中去,以应用纳米新材料给人民币进行杀菌、消毒.该材料属于( )
| A. | 耐高温材料 | B. | 耐压材料 | C. | 复合材料 | D. | 耐腐蚀材料 |
13.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 1mol丙烷分子中,含有的非极性共价键数目为NA | |
| B. | 标准状况下,1.8gH2O分子中所含有的电子数为NA | |
| C. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| D. | 2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
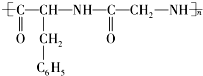 的单体是( )
的单体是( )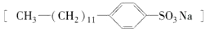 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:

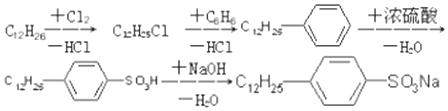
 .
. ,反应类型为取代反应.
,反应类型为取代反应.