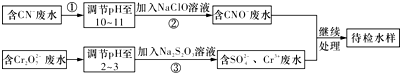
题目内容
19.下列反应离子方程式错误的是( )| A. | 少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=2HClO+SO32- | |
| B. | 碳酸钙中滴入醋酸溶液:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O | |
| D. | 硫酸亚铁溶液中加过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
分析 A.发生氧化还原反应生成硫酸钠;
B.反应生成醋酸钙、水、二氧化碳;
C.反应生成碳酸钙、氢氧化镁和水;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.少量SO2气体通入NaClO溶液中的离子反应为SO2+H2O+ClO-=2H++Cl-+SO42-,故A错误;
B.碳酸钙中滴入醋酸溶液的离子反应为CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,故B正确;
C.碳酸氢镁溶液中加入过量的澄清石灰水的离子反应为Mg2++2HCO3-+Ca2++4OH-=CaCO3↓+Mg(OH)2↓+2H2O,故C错误;
D.硫酸亚铁溶液中加过氧化氢溶液的离子反应为2Fe2++2H++H2O2=2Fe3++2H2O,故D正确;
故选AC.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意氧化还原反应及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
1.在某无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | NH4+、SO42-、Al3+、Cl- | B. | Na+、OH-、K+、Cl- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、NO3-、I-、Na+ |
14.铝土矿的主要成分为氧化铝,还有少量的氧化铁和二氧化硅杂质.工业上经过下列工艺可以冶炼金属铝:
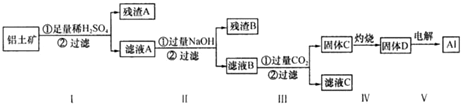
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 滤液A 可用于净水,其净水原理为Al3++3H2O═Al(OH)3+3H+ | |
| B. | 固体C→固体D 的操作过程中主要仪器是酒精灯、蒸发皿、玻璃棒 | |
| C. | 滤液C 中存在以下关系:c(Na+)=c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+) | |
| D. | 若在100 mL 滤液B 中加入1 mol•L-1HCl 200 mL,沉淀达到最大且质量为11.7 g,则滤液B 中c(Na+)大小2 mol•L |