题目内容
10.造纸工业中常用Cl2漂白纸浆,漂白后的纸浆用NaHSO3除去残留的Cl2,其反应为:Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl,在这个反应中,氧化产物与还原产物的物质的量之比为( )| A. | 2:3 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
分析 Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl中,Cl元素的化合价降低得到电子被还原,S元素的化合价升高失去电子被氧化,结合电子及原子守恒计算.
解答 解:Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl中,S元素的化合价升高失去电子被氧化,则H2SO4为氧化产物,Cl元素的化合价降低得到电子被还原,则NaCl、HCl为还原产物,由反应可知,生成1mol氧化产物时,得到2mol还原产物,则氧化产物与还原产物的物质的量之比为1:2,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
5.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3溶液:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>C(OH-) | |
| C. | 氯气溶于水达到平衡后,若其他条件不变加入CaCO3固体,$\frac{c({H}^{+})}{c(HClO)}$增加 | |
| D. | NaSiO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
2.下列推论正确的是( )
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完反应,放出的热量为28.7 kJ | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 | |
| D. | 2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则碳的燃烧热等于 110.5 kJ/mol |
19.25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布图如下,下列结论正确的是( )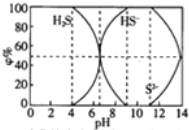

| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Kφ(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
17.向200mL 18mol/L H2SO4溶液中加入足量的铜片,加热使之反应,则充分反应后,被还原的H2SO4的物质的量可能是( )
| A. | 1.5mol | B. | 1.81mol | C. | 2.5mol | D. | 3.6mol |
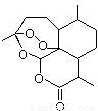
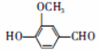 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: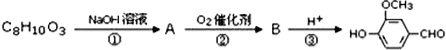
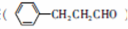 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应: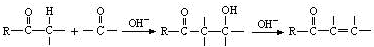
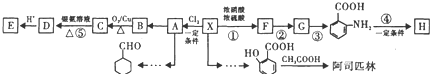
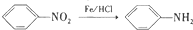 (苯胺、易被氧化)
(苯胺、易被氧化)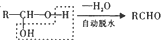
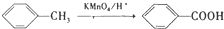
 ;
;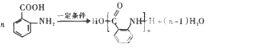 ;
;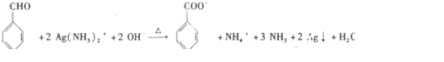 .
.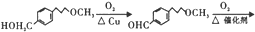 完成
完成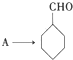 的流程图
的流程图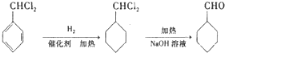 ;
; Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应
Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应